李新刚,赵志刚*
首都医科大学附属北京天坛医院药剂科,北京 100050
[摘要] 目的:分析苯妥英与拉莫三嗪致严重皮肤不良反应与人类白细胞抗原(humanleucocyte antigen,HLA)-B*1502等位基因的关联性。方法:计算机检索截止2013年9月的ISI Web of Knowledge、PUBMED、ScienceDirect、EBSCO、Cochrane、CNKI和万方数据库,收集有关苯妥英与拉莫三嗪致严重皮肤不良反应与HLA-B*1502等位基因相关性的研究,采用Review Manager 5.2对符合纳入标准的研究进行Meta分析。结果:共纳入6篇英文研究。Meta分析结果表明,苯妥英和拉莫三嗪的合并OR值分别为5.65 [95% CI: 2.76-11.5]和3.97 [95% CI: 1.36-11.61]。漏斗图显示所纳入的研究未见明显的发表偏倚。结论:HLA-B*1502等位基因与苯妥英和拉莫三嗪致严重皮肤不良反应间存在明显的相关性。
[关键词] 苯妥英;拉莫三嗪;HLA-B*1502;Meta分析
A Meta-analysis on the Association between HLA-B*1502 and Phenytoin or Lamotrigine induced Severe Cutaneous Adverse Drug Reaction
LI Xin-gang, ZHAO Zhi-gang*
Department of pharmacy, Beijing Tiantan Hospital Affiliated to Capital Medical University, Beijing 100050, China
[Abstract] Objective: To analyze the effects of humanleucocyte antigen (HLA)-B*1502 on phenytoin and lamotrigine induced severe cutaneous adverse drug reaction. Methods: ISI Web of Knowledge、PUBMED、ScienceDirect、EBSCO、Cochrane、CNKI and wanfang data were searched for the literature published before September 2013. Meta-analysis were performed by Review Manager 5.2 software. Results: 6 English studies were included finally. Meta-analysis showed that OR of phenytoin and lamotrigine were 5.65 [95% CI: 2.76-11.5] and 3.97 [95% CI: 1.36-11.61], respectively. Funnel plot analysis showed symmetry, indicting less possible publication bias and the result was partly reliable. Conclusion: There is a significant association between HLA-B*1502 and phenytoin and lamotrigine-induced severe cutaneous adverse drug reaction.
[Keywords] phenytoin; lamotrigine; HLA-B*1502; Meta-analysis
人类白细胞抗原(humanleucocyte antigen,HLA)位于人类染色体6p21.3,是一群紧密连锁有复等位基因,包括100余个基因座共有554个等位基因,全长3600kb,是调控人体特异性免疫应答和决定疾病易感性个体差异的主要基因系统,在种族间和同族的不同群体间具有明显的特异性[1]。HLA-B*1502是HLA基因B位点的一个基因亚型,几乎只存在于亚洲人种之中,其中中国汉族人(包括台湾地区)、菲律宾人、马来西来人和泰国人的携带率估计在10%~15%之间,包括印度人在内的南亚人群携带者约为2%~4%,而在日本和韩国人群中的携带者极少。2007年12月12日,美国食品药品监督管理局(Food and Drug Administration,FDA)向医务人员提出警示:卡马西平会增加HLA-B*1502阳性亚裔患者出现Stevens-Johnson综合症(Stevens-Johnson syndrome,SJS)和中毒性表皮坏死松解症(toxic epidermal necrolysis,TEN)出现的风险,因此应避免将卡马西平应用于此类患者,除非效益明显大于风险,相关信息已写入卡马西平的说明书中。2008年11月24日,FDA又发布消息称,他们正在调查关于苯妥英(phenytoin,PHT)用于HLA-B*1502等位基因阳性患者亚裔患者治疗出现JSJ/TEN的初步数据[2]。此外还有多项研究发现:HLA-B*1502等位基因与拉莫三嗪(lamotrigine,LTG)致SJS/TEN可能存在一定的相关性[3-7],但尚未得到一致结论。此次系统评价对已有研究进行Meta分析,综合以往研究结果,希望更准确的评价PHT和LTG致SJS/TEN与HLA-B*1502等位基因的相关性。
1 资料与方法
1.1 文献检索
计算机检索截止2013年9月的ISI Web of Knowledge、PUBMED、ScienceDirect、EBSCO、Cochrane、CNKI和万方数据库,查找HLA-B*1502与苯妥英和拉莫三嗪致SJS/TEN相关性的原始研究。检索策略采用包括“抗癫痫药物(antiepileptic drugs)”或“苯妥英(phenytoin)”或“拉莫三嗪(lamotrigine)”和“HLA”或“HLA-B*1502”或“人白细胞抗原(humanleucocyte antigen)”等相关中英文文献检索词进行检索,只检索以中文或英文发表的相关文献。此外,对纳入文献的参考文献进行阅读以补充检索。
1.2 纳入与排除标准
纳入Meta分析的研究必须满足如下标准:①研究中同时设有不良反应组与对照组;②研究纳入的患者均为癫痫病人;③确定严重的皮肤不良反应是由患者使用苯妥英或拉莫三嗪导致;④所有患者全部进行HLA-B*1502检测。符合以下任意一条或多条标准的均须排除于Meta分析之外:①患者同时服用多种抗癫痫药物引起的严重皮肤不良反应;②样本量小于3名患者;③只有摘要的文献;④数据不完整的文献;⑤重复报告的文献。由两名评价人员独立通过浏览题目,摘要选择相关文献,然后查找出相关文献全文,阅读全文,依据纳入与排除标准对文献进行评价,选择相符的文献。按预先制定的资料提取表提取相关数据,所有数据均由非提取人员进行核查以确保准确。对存在争议的文献可通过讨论或咨询第三位评价人员的意见进行裁定。
1.3 统计分析方法
采用Review Manager 5.2软件进行Meta分析,采用比值比(odds ratio, OR)及其95%置信区间(confidence interval,CI)为效应指标来比较,检验水平为P = 0.05,P < 0.05则认为组间存在显著差异,否则为无统计学差异。在分析过程中采用χ2检验来评价纳入研究的异质性,若异质性检验结果为P > 0.1,说明多个研究间具有同质性,采用固定效应模型;反之则说明研究间不具有同质性,首先进行异质性分析和处理,若仍无法消除异质的资料,可采用随机效应模型。
2 结果
2.1 纳入研究的基本情况
依入排标准最终纳入6篇文献[3-8],涉及9项对照研究和468名癫痫患者,具体检索流程见图1。纳入文献的发表时间为2007至2013年,除Locharemkul的研究人群为泰国人外,其余研究对象均为中国汉族人群或后裔。苯妥英致严重皮肤不良反应与HLA-B*1502等位基因的关联性有4项研究,不良反应组46例,对照组246例;拉莫三秦致严重皮肤不良反应与HLA-B*1502等位基因的关联性有5项研究,不良反应组19例,对照组157例。
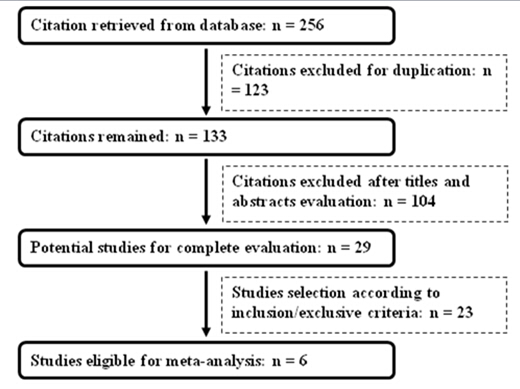
图1 纳入文献的筛选流程图
Fig. 1 Identification of eligible studies
2.2 HLA-B*1502等位基因与苯妥英致严重皮肤不良反应关联性Meta分析
纳入4项研究,依Review Manager 5.2软件的要求输入研究及数据,Meta分析的森林图见图2。异质性检验显示P = 0.47,表明各个研究间具有同质性,可以采用固定效应模型法进行分析。SJS/TEN组纳入46例患者,其中20例携带有HLA-B*1502基因,对照组246例患者中34为HLA-B*1502阳性。合并OR(95% CI)为5.65 [2.76 ~ 11.57],总体效应检测P < 0.00001,表明HLA-B*1502等位基因与苯妥英致严重皮肤不良反应间具有很强的相关性。
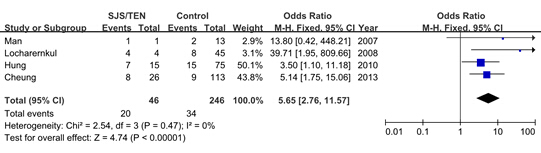
图 2 HLA-B*1502等位基因与苯妥英致SJS/TEN间关系的Meta分析森林图
Fig. 2 Forest plot of meta-analysis for association between HLA-B*1502 and Phenytoin-induced SJS/TEN
2.3 HLA-B*1502等位基因与拉莫三嗪致严重皮肤不良反应关联性Meta分析
有5项研究最终纳入了Meta分析,SJS/TEN组19例患者中6例是HLA-B*1502基因携带者,对照组的157名患者中有16人携带HLA-B*1502等位基因。各研究间具有较好的同质性(P = 0.85),因此采用固定效应模型法进行分析。合并OR(95% CI)为3.97 [1.36 ~ 11.61],总体效应检测P = 0.01,表明HLA-B*1502等位基因与拉莫三嗪致严重皮肤不良反应间具有显著的相关性。
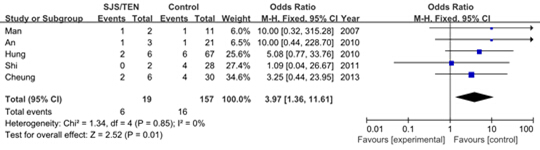
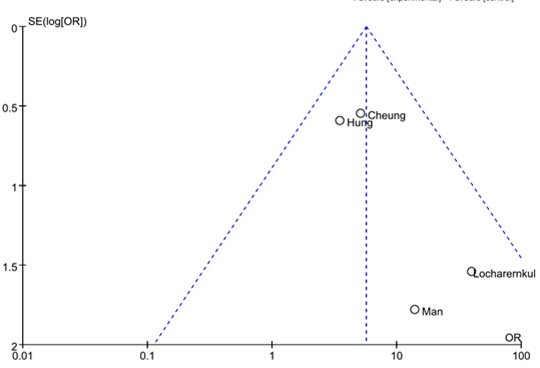
图 3 HLA-B*1502等位基因与拉莫三嗪致SJS/TEN间关系的Meta分析森林图
Fig. 3 Forest plot of meta-analysis for association between HLA-B*1502 and lamotrigine-induced SJS/TEN
2.4 发表偏倚评估
应用Review Manager 5.2软件对纳入研究进行发表偏倚分析,结果见图4和图5。两研究的漏斗图基本对称,表明分析中不存在发表偏倚。
图4 HLA-B*1502与苯妥英致SJS/TEN相关性Meta分析的漏斗图
Fig. 4 Funnel plot for publication bias in meta-analysis of association of HLA-B*1502 and phenytoin-induced SJS/TEN
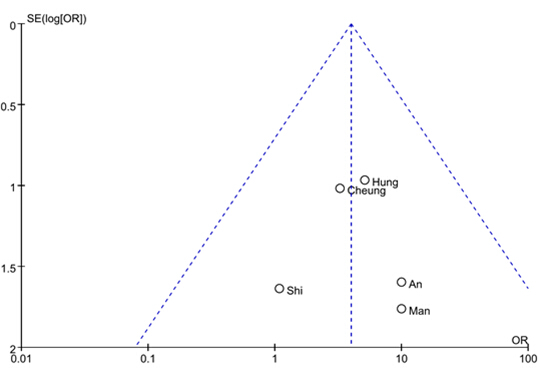
图5 HLA-B*1502与拉莫三嗪致SJS/TEN相关性Meta分析的漏斗图
Fig. 5 Funnel plot for publication bias in meta-analysis of association of HLA-B*1502 and lamotrigine-induced SJS/TEN
3 讨论
苯妥英、拉莫三嗪、磷苯妥英与卡马西平均属于芳香类抗癫痫药物,其中卡马西平致SJS/TEN与HLA-B*1502的相关性已得到了确认,且相关警示已写入药品说明书中。虽然已有文献报道,但其它几个药物致SJS/TEN与HLA-B*1502等位基因的关系仍未得到明确[3-8]。本研究Meta分析显示:HLA-B*1502等位基因与苯妥英和拉莫三嗪致SJS/TEN有显著的相关性。磷苯妥英是苯妥英的前体药物,在体内转化为苯妥英后发挥抗癫痫作用,故而关于苯妥英的任何风险磷苯妥英同样存在[2]。从研究数据中我们可以看到,不是所有出现SJS/TEN的患者均为HLA-B*1502等位基因携带者,也并不是所有HLA-B*1502等位基因携带者均会发生SJS/TEN,这说明SJS/TEN的发生还有其它因素有关。
抗癫痫药物引发SJS/TEN的机制尚不清楚,除了与基因多态性因素有关外,也可能存在免疫学方面的因素。有学者发现卡马西平与HLA-B*1502结合的多肽间以非共价键结合,从而引起了SJS/TEN患者细胞毒性T细胞反应[9]。研究者还发现患者对卡马西平、苯妥英或拉莫三嗪过敏时,药物特异性T细胞大量表达Vβ5.1细胞受体,这表明Vβ5.1可能在药物的致敏反应中发挥重要作用[10-12]。
在解释基因型与药物不良反应之间的关系时应该非常谨慎,随着研究的不断深入,会有更多的基因被发现,多种基因可能与药物的不良反应相关。以卡马西平为例,除了已经明确的HLA-B*1502外,HLA-B*3101[13]、HLA-B*5801和HLA-B*4001[7]等位基因均可能与卡马西平致SJS/TEN存在相关性。如何排除其它基因的影响,单独研究特定基因与药物致敏之间的关系,可能会成为此类研究的发展方向。除基因因素外,还有许多非遗传因素可能会使药物产生致SJS/TEN,但受限于纳入研究信息量的不足,不能对这些因素一一考察。此外,本次Meta分析中纳入的研究没有统一的试验设计方案,符合标准的文献仅有几篇、纳入的病例数较少、苯妥英和拉莫三嗪的给药剂量和用药时间也不完全相同,这些都会使本次系统评价的结果产生一定的偏倚。
4 结语
综上所述,HLA-B*1502等位基因与苯妥英和拉莫三嗪致严重皮肤不良反应显著相关,但药物致严重皮肤不良反应还受到了多种其它基因的影响,仍需要大样本高质量的前瞻性研究来确认。
参考文献
[1] 石奕武. 芳香族抗癫痫药物导致皮肤型药物不良反应与HLA基因的关系进展[J]. 实用医学杂志, 2012, 28(13): 2119-2121.
[2] 美国警示携带HLA-B*1502等位基因的患者使用苯妥英可能导致严重皮肤反应[J]. 中国药物警戒, 2009, 6(2): 122-123.
[3] An DM, Wu XT, Hu FY, Yan B, Stefan H, Zhou D. Association study of lamotrigine-induced cutaneous adverse reactions and HLA-B*1502 in a Han Chinese population[J]. Epilepsy Res. 2010, 92(2-3):226-230.
[4] Shi YW, Min FL, Liu XR, Zan LX, Gao MM, Yu MJ, Liao WP. Hla-B alleles and lamotrigine-induced cutaneous adverse drug reactions in the Han Chinese population[J]. Basic Clin Pharmacol Toxicol. 2011, 109(1): 42-46.
[5] Man CB, Kwan P, Baum L, Yu E, Lau KM, Cheng AS, Ng MH. Association between HLA-B*1502 allele and antiepileptic drug-induced cutaneous reactions in Han Chinese[J]. Epilepsia. 2007, 48(5): 1015-8.
[6] Hung SI, Chung WH, Liu ZS, Chen CH, Hsih MS, Hui RC, Chu CY, Chen YT. Common risk allele in aromatic antiepileptic-drug induced Stevens-Johnson syndrome and toxic epidermal necrolysis in Han Chinese[J]. Pharmacogenomics. 2010, 11(3):349-356.
[7] Cheung YK, Cheng SH, Chan EJ, Lo SV, Ng MH, Kwan P. HLA-B alleles associated with severe cutaneous reactions to antiepileptic drugs in Han Chinese[J]. Epilepsia. 2013, 54(7): 1307-1314.
[8] Locharernkul C, Loplumlert J, Limotai C, Korkij W, Desudchit T, Tongkobpetch S, Kangwanshiratada O, Hirankarn N, Suphapeetiporn K, Shotelersuk V. Carbamazepine and phenytoin induced Stevens-Johnson syndrome is associated with HLA-B*1502 allele in Thai population[J]. Epilepsia. 2008, 49(12): 2087-91.
[9] Yang CW,Hung SI,Juo CG, Lin YP, Fang WH, Lu IH, Chen ST, Chen YT. HLA-B*1502-bound peptides: implications for the pathogenesis of carbamazepine-induced Stevens-Johnson syndrome[J]. J Allergy Clin Immunol, 2007, 120(40): 870-877.
[10] Naisbitt DJ, Britschgi M, Wong G, Farrell J, Depta JP, Chadwick DW, Pichler WJ, Pirmohamed M, Park BK. Hypersensitivity reactions to carbamazepine: characterization of the specificity, phenotype, and cytokine profile of drug specific T cell clones[J]. Mol Pharmacol, 2003, 63(3): 732-741.
[11] Hashizume H,Takigawa M,Tokura Y. Characterization of drug-specific T cells in phenobarbital-induced eruption[J]. J Immunol, 2002, 168(10): 5359-5368.
[12] Naisbitt DJ,Farrell J,Wong G,Depta JP, Dodd CC, Hopkins JE, Gibney CA, Chadwick DW, Pichler WJ, Pirmohamed M, Park BK. Characterization of drug-specific T cells in lamotrigine hypersensitivity[J]. J Allergy Clin Immunol, 2003, 111(6): 1393-1403.
[13] Thorn CF, Leckband SG, Kelsoe J, Leeder JS, Müller DJ, Klein TE, Altman RB. PharmGKB summary: carbamazepine pathway[J]. Pharmacogenet Genomics. 2011, 21(12):906-910
北京药学会 地址:北京市朝阳区北三环中路2号小二楼2层
本网站浏览47476012次
Copyright 2012 北京药学会( 本网站所有内容未经许可,不得以任何形式进行转载 ) All Rights Reservered