赵铁a,张浩军b,张相林a,赵婷婷b,蓝辉耀c,罗国安d,李平b*
(a. 中日友好医院 药学部,北京 100029;
b. 中日友好医院 临床医学研究所药物药理室,北京 100029;
c. 香港中文大学李嘉诚健康研究所&医疗系;d. 清华大学生物有机磷化学&化学生物学教育部重点实验室)
[第一作者]赵铁,主管药师,从事代谢组学和中药有效组分研究,Tel:010-84205248,E-mail:tiezhao@qq.com
[通讯作者]*李平,教授,从事慢性肾脏病中药药理研究,Tel:010-84205633,E-mail:" lp8675@yahoo.com.cn
[摘要] 目的:研究柴黄益肾颗粒干预对糖尿病肾病(DN)大鼠肾脏异常代谢物的调节作用。 方法:采用单侧肾切除加i.p.链脲佐菌素诱导的方法复制DN大鼠模型,将48只Wistar大鼠分成5组,包括空白组、模型组、模型+柴黄益肾颗粒组、模型+福辛普利组、空白+柴黄益肾颗粒组。大鼠分别灌胃给予柴黄益肾颗粒和福辛普利,于第20周,采集肾皮质样品进行基于液质联用的代谢组学和脂质组学研究,考察干预前后代谢物谱的变化。 结果:柴黄益肾颗粒干预能够显著回调DN大鼠肾皮质中升高的有机毒素分子,包括尿毒素和葡糖糖苷酸物质,以及降低的鞘脂代谢物。 结论:柴黄益肾颗粒干预可以延缓大鼠DN的进展,该机制可能与其对有机毒素和鞘脂代谢异常的调节有关。
[关键词] 糖尿病肾病;柴黄益肾颗粒;代谢组学;脂质组学;超高压液相-四级杆飞行时间质谱联用仪
Intrarenal Metabolomic Study of the Protective Effect of
Chaihuang-Yishen Granule on Rats With Diabetic Nephropathy
Tie Zhaoa, Haojun Zhangb, Xianglin Zhang a, Tingting Zhaob, Huiyao Lanc ,Guoan Luod, Ping Lib
aDepartment of Pharmacy, China-Japan Friendship Hospital, Beijing, China. bDepartment of Pharmacology, Institute of Clinical Medical Sciences, China-Japan Friendship Hospital, Beijing, China. cDepartment of Medicine and Therapeutics, and Li Ka Shing Institute of Health Sciences, the Chinese University of Hong Kong, Hong Kong SAR, China. dKey Laboratory of Bioorganic Phosphorus Chemistry & Chemical Biology (Ministry of Education), Department of Chemistry, Tsinghua University, China,
[Abstract] Objective: To study the protective effect of Chaihuang-Yishen granules on dysregulated metabolism in kidney of rats with DN. Method: Wistar rats were undergone uninephrectomy and a single intraperitoneal injection of streptozocin to induce diabetes, and administratered with chaihuang-Yishen granules and fosinopril. At the end of 20 weeks, renal cortex of rats were removed and used to UPLC-QTOF MS based metabolomic and lipidomic study, investigating the alterations of globally abnormal metabolome after administration of Chaihuang Yishen granules. Result: Chaihuang-Yishen granules can significantly normalize the elevated organic toxins including uremic toxins and glucuronides, and declined sphingomyelins. Conlusion: Chaihuang-Yishen gruanules can retard the development of DN in rats, which might be associated with its regulation in abnormally expressed metabolites, especially organic toxins and sphingomyelins.
[Key words] diabetic nephropathy; Chaihuang-Yishen granules; metabolomics; lipidomics; UPLC-QTOF MS
糖尿病肾病(Diabtetic Nephropathy, DN)是糖尿病最严重的微血管并发症之一,也是终末期肾病的一个主要原因[1-3]。将近1/3的1型糖尿病患者和大约25%的2型糖尿病患者会发展成糖尿病肾病[4]。糖尿病肾病是一种复杂的慢性代谢性疾病[5]。尽管高血糖是公认的DN发生的先决条件,并且近些年学者们也提出了许多关于糖尿病肾病发病机制的假说[6],但DN的深层次的发生发展的机理至今仍不清楚。中医药在治疗慢性肾脏病方面具有独特的优势和特色[3, 7]。我室李平主任结合时振声教授的临证经验和前期的研究成果研制出了由柴胡、黄芪等7味中药组成的柴黄益肾颗粒。长期的临床观察证明:该方对慢性肾炎蛋白尿具有明显的治疗作用,特别是对一些难治性肾脏病,疗效尤为显著。作者也进行了柴黄益肾颗粒保护DN的药效学的预试验研究,结果表明,柴黄益肾颗粒能够有效地延缓DN的进展,但其作用机制还有待研究。
以整体代谢指纹或轮廓分析为特点的代谢组学在DM等代谢性疾病研究领域里逐渐引起重视[8-10]。目前许多研究组已经开展了DN的代谢组学研究[11-13],他们中大多是基于临床或动物的血尿样本的研究。糖尿病肾病,作为一种受累器官明确的继发性疾病来说,针对肾脏皮质组织的代谢组学研究将比血液尿液的代谢组学研究更具有特异性。
脂类物质是组成生物体的基本物质之一,在生物体内复杂的生理反应过程中扮演着十分重要的角色。近年来,已有许多研究者通过脂质组学的研究发现,许多异常的生理状态都与脂代谢紊乱相关,例如糖尿病、肥胖症、动脉粥样硬化、冠心病以及脑损伤等[14-15]。
在以前的研究中,为了能够更深入的了解DN发病的机制,我们分别利用代谢组学[16]和脂质组学[17]分析技术,以STZ诱导的DN大鼠为模型,分析了肾皮质中与DN相关的异常代谢物和脂质成分,探讨了其在DN发展过程中的作用。本研究中,我们将在此前研究的基础上,应用整合代谢和脂质组学平台,进一步探讨柴黄益肾颗粒及其对照药福辛普利的相关作用机制,为复方中药防治DN提供科学依据。
1 材料
1.1 药物及试剂 柴黄益肾颗粒由黄芪(503 g)、当归(252 g)、柴胡(252 g)、穿山龙(377 g)、石韦(302 g)、猪苓(302 g)和水蛭(76 g)7味中药组成。取黄芪、石韦、猪苓、水蛭加12倍水煎煮3次,每次1.5 h,合并煎液,滤过,滤液浓缩至相对密度为1.28~1.30的稠膏。当归、穿山龙、柴胡加5倍量60%乙醇浸渍提取3次,每次浸泡3 d,合并3次提取液,减压浓缩得相对密度为1.28~1.30 的稠膏。合并两部分稠膏,混匀,真空干燥,粉碎,过60目筛得干粉,加糊精约1.4倍到1 000 g,混匀,加75%乙醇适量制粒,干燥,分装(每袋8 g),即得。成品质量控制要求含薯蓣皂苷(C45H72O16)不得少于2.50 mg.g-1。以蒸馏水按0.56 g.kg-1的给药剂量配制成溶液,4 ℃保存,有效期6 d,灌胃给药前取出放置至室温。血糖试纸(强生公司),考马斯亮蓝G250(Sigma公司),水合氯醛(北京化学试剂公司,分析纯),甲醛溶液(国药集团化学试剂有限公司,分析纯),肌酐试剂盒(北京北化康泰临床试剂公司),链脲佐菌素(美国Sigma公司),提取溶剂甲醇、氯仿(德国Merck公司)均为等度色谱纯,流动相溶剂乙腈、异丙醇(德国Merck公司)均为梯度色谱纯,2,6-di-tert-butyl-4-methylphenol (BHT,美国,Sigma公司)。总蛋白(TP)试剂盒(批号09-0622)、白蛋白(ALB)试剂盒(批号09-0921)和血尿素氮(BUN)试剂盒(批号09-09279)购于G-Cell公司,血肌酐(Scr)试剂盒(批号:61773401)购于罗氏公司,血清总胆固醇(TC)试剂盒(批号20091001)、甘油三酯(TG)试剂盒(批号20091101)购于申索公司。
1.2 仪器 CD-1600全自动生化分析仪(雅培公司),One Touch Ultra II稳豪二代血糖仪(强生公司),BX-51显微镜(奥林巴斯公司),组织匀浆机T10 basic(IKA, Staufen, Germany),离心浓缩仪(太仓市科教仪器厂),超高压液相色谱(Acquity,美国沃特世科技有限公司),四级杆飞行时间质谱联用仪(Xevo G2,美国沃特世科技有限公司),液相色谱柱(BEH, 1 mm×50 mm, 1.7 μm,美国沃特世科技有限公司),高效液相色谱仪:Agilent 1100 Series。
2方法
2.1 动物模型及实验设计
Wistar大鼠48只,SPF级,雄性,8周龄,体重180~220 g,北京维通利华实验动物技术有限公司提供,许可证号SCXK(京) 2007-0001。饲养于中日友好医院动物室屏障系统,许可证号SYXK(京) 2005-0019。实验期间,大鼠给予普通饲料(中国医学科学院实验动物研究所提供),自由饮水、进食。整个实验过程,全部动物的饲养条件为温度20~25 ˚C,湿度65%~69%,12 h光照/黑暗循环,期间自由进食和饮水。
动物购入后适应性喂养1周,进行基础状态测定,剔除血糖与尿蛋白异常的动物,其余动物先按体重随机进行手术和假手术处理。
假手术:大鼠以3.3 mL·kg-1腹腔注射10%水合氯醛麻醉,背部进行术前备皮,常规消毒,背部切口1~1.5 cm,充分暴露右肾,剥离肾脏脂肪包膜,缝合切口。术后1周以4 mL·kg-1的剂量腹腔注射0.1 mmol·L-1柠檬酸-柠檬酸钠缓冲液。
手术:大鼠麻醉、备皮及消毒处理同假手术组,背部切口1~1.5 cm,暴露右肾,剥离肾脏脂肪及肾上腺,结扎右肾门血管,切除右肾[18],缝合切口。术后动物恢复1周后,按40 mg·kg-1腹腔注射1%的链脲佐菌素,72 h后尾尖采血测血糖,以血糖高于16.7 mmol·L-1做为模型成功标准。
假手术动物按体重和血糖随机分为空白组和空白+柴黄益肾颗粒组,手术造模成功动物按体重和血糖随机分为模型组和模型+柴黄益肾颗粒组,具体分组与给药方案如下:
空白组(C):假手术+柠檬酸缓冲液+等容积蒸馏水(n=11)
模型组(M):单侧肾切除+Stz注射+等容积蒸馏水(n=10)
模型+柴黄益肾颗粒组(CH):单侧肾切除+Stz注射+柴黄益肾颗粒组(0.56 g·kg-1,相当于临床剂量5倍)(n=12)
模型+福辛普利组(F):单侧肾切除+Stz注射+福辛普利(1.67mg/kg)(相当于临床剂量5倍)(n=11)
空白+柴黄益肾颗粒组(CHC):假手术+柠檬酸缓冲液+柴黄益肾颗粒(1.12 g·kg-1)(n=5)
各组大鼠分笼饲养,自由饮食进水,给药方式为ig给药,每日1次,于上午进行,连续给药20周。
造模后第0,4,8,12,16,20周,大鼠尾尖采血测血糖,同时将大鼠转入代谢笼内,禁食不禁水,收集24 h尿液。于20周末禁食不禁水12 h,以3.3 mL·kg-1的剂量ip 10%的水合氯醛麻醉动物,眼眶后静脉丛取血,离心后取血清;大鼠在经过在体心脏灌流后,立即取出左肾,剥离肾包膜,纵剖为两片,取一片固定于10 %中性甲醛溶液以进行组织病理学检查,另一片剪下肾皮质并分成两份,一份40mg,一份60mg,精密称重,置于2mL离心管中,置超低温冰箱中保存,待用。
2.2 指标检测及病理分析
2.2.1 一般状态 动物每周称体重,密切观察动物精神状态,反应性,毛发色泽,饮食及排泄状况。
2.2.2血生化指标 用血糖仪测定各时间点血糖值,取血清,用全自动血生化分析仪测定血清总蛋白(TP)、白蛋白(ALB)、血尿素氮(BUN)、肌酐(Scr)、血清总胆固醇(TC)、甘油三酯(TG)。
2.2.3 尿蛋白 将各时间点收集的尿液以3 000 r·min-1离心10 min,吸取上清,用考马斯亮蓝法检测尿蛋白浓度。
2.2.4 组织病理学指标[19] 肾组织经10%福尔马林固定24 h后,常规脱水,透明,石蜡包埋,经切片机分别切为3 µm厚切片,进行PAS染色,光镜下观察肾组织病理学变化。
2.3 代谢组学分析[16]
为减少仪器带来的系统误差,我们全部的分析都按照“对照组-模型组-柴黄组-福辛普利组-中药对照组-福辛普利组-柴黄组-模型组-对照组”的顺序交叉测定,并在分析全过程中设置质控(QC)样品,监控分析结果的质量,必要时可适当用于数据的校正。
我们利用整合GC-tofMS和LCtofMS平台进行肾皮质代谢组学分析,两分析仪器公用一部分相同的样品前处理方法:新鲜的肾皮质组织(60mg)从超低温冰箱中取出,立即加入800uL甲醇和20uL二元内标混合溶液(L-2-chlorophenylalanine and heptadecanoic acid at concentration level 0.5 mg/mL),在冰浴上匀浆2次,每次30秒。所得匀浆液被储存在4℃冰箱中过夜,然后在4°C下以12000转/分的速度离心10分钟,所得上清液等分成两份,每份300uL,分别用于LC-tofMS和GCtofMS分析。
GCtofMS分析
将300uL上清液转移到带有内插管的样品瓶中,在真空离心浓缩干燥仪上浓缩至干,然后进行三甲基硅烷(TMS)衍生化。衍生化步骤与以前的报道[20]类似,略有调整。简要的说,将50-µL 甲氧胺(15 mg/mL溶解在吡啶中) 溶液加入干燥的样品中,涡旋振荡30秒,然后置于摇床中恒温30°C,肟化羰基,90分钟后取出,加入50 µL BSTFA (containing 1% TMCS),涡旋振荡30秒,静置于70°C鼓风干燥箱中硅烷化反应1小时。
衍生化后的样品以不分流模式注入到GCtofMS中进行分析,进样量为1µL, 色谱柱为DB-5 毛细管柱(30 m × 250 µm i.d., 0.25-µm film thickness),载气为氦气,流速为1.0 mL/min。进样温度设定为270°C。柱温梯度为80°C 维持2分钟,然后以10°C/分钟程序升温至180°C,5°C/分钟升至240°C,25°C /分钟至290°C,维持9分钟,然后回到起始温度。传递线(Transfer line)温度和离子源温度分别为260°C和200°C。质谱采用电子轰击源(70ev)及全扫描模式,扫描范围为m/z 30-600。
UPLCtofMS分析
将另300ul上清液转移至高回收样品瓶中,进行UPLCtofMS分析。色谱柱为反相C18 柱(10 cm×2.1mm, 1.7μm),柱温恒定为50℃,流动相梯度为5–50% B(0-3 min),50-70% B( 3-10min) 70-100% B(10-15 min), 100%B保持5min,这里A=水(0.1% ammonium formate),B=乙腈。流速为0.4 mL/min,进样量:2ul(ESI+),4ul(ESI-).样品按照正常-模型-柴黄益肾颗粒-福辛普利-正常对照的顺序分析。样本室温度为4℃。
质谱数据的采集在Micromass 飞行时间质谱(LCT Premier XE)上进行。扫描范围为50 to 600 m/z,扫描时间0.2秒,扫描间隔时间0.05秒,整个分析时长28分钟。源温为120℃,锥孔气流50 L/h,脱溶剂气流600 L/h,脱溶剂气体温度350℃。 毛细管和锥孔电压分别为2.3kV和40V。质谱操作在W optics mode下,分辨率为12,000,开启动态范围扩展功能(DRE)。亮氨酸脑啡肽(Leucine enkephalin)作为 lock mass ,浓度为2μg/mL ,流速为20μL/min, lockspray frequency为10秒。 系统工作站为MassLynx software (Waters),用于仪器控制和数据采集。
2.4 脂质组学分析[17, 21] 从超低温冰箱或液氮中取出装有40 mg肾皮质的离心管,立即加5元内标30 µL,再加入提取溶剂(甲醇/氯仿=2:1,含0.01 %BHT)700 µL,最高档匀浆30 s,停2 min,如此反复2次。静置30 min后,加入550 µL氯仿和350 µL生理盐水(0.9 % NaCl),涡旋30 s,10 000 r·min-1离心5 min,尽可能多的吸取下层清液,置于离心管中,分取550 µL和50 µL置于两样品瓶中,离心浓缩至干后加50 µL甲醇/氯仿(1:1)混合溶剂,涡旋 30 s复溶,再加入200 µL甲醇稀释,分别进行正负离子模式的脂质指纹谱分析。
流动相A为含1%甲酸铵(1M)的乙腈/异丙醇(5/2),B为1%甲酸铵。A从35%线性升高到65%(0~3 min),维持1 min,然后线性升高到95%(4~6 min),再逐渐升高到100%(6~9 min),维持3 min后,逐渐回到起始梯度,整个分析过程共计17 min,柱温50 ℃,流速恒定为0.2 mL·min-1,进样量为1 µL。
质谱采用电喷雾离子化模式,源温为120°C,脱溶剂气流速和温度分别为600 L·h-1和350 °C,质量扫描范围400~1 000 amu,正离子模式(ES+)和负离子模式(ES-)的毛细管电压分别为3.0和2.5 kV。Lockspray mass是2 mg·L-1的亮氨酸脑啡肽溶液。
分析过程按照“空白组-模型组-模型+柴黄益肾颗粒组-空白+柴黄益肾颗粒组”的顺序交叉测定,并在全过程中设置质控(QC)样品。
2.5 数据处理及统计分析
2.5.1代谢组数据处理及结构鉴定
GCtofMS数据
将GCtofMS分析所得的质谱数据由ChromaTOF工作站软件以NetCDF格式导出。这些CDF文件用Matlab 7.0工具箱中hierarchical multivariate curve resolution (H-MCR)修改的用户自定义程序[22-23]进行数据前处理提取特征变量,包括基线矫正、去噪、平滑、对齐,时间-窗口分裂,多元曲线分离(基于多元曲线分离算法)等。所得三维数据集包括样品信息、峰保留时间和峰强度。数据集中内标和由噪音,柱流失及BSTFA衍生化引起的人造峰须先被除去。葡萄糖的相关峰在数据归一化前也要去掉。归一化是将每个峰的强度除以一个样品全部峰强度的总和。
所得数据集导入SIMCA-p 11.5 软件进行多元统计分析。数据首先经过中心化和Parto处理,然后进行主成分分析(PCA)或偏最小二乘判别分析(PLSDA)。PCA是一种非监督的模式识别方法,可以用来判断多维数据集的一般聚类情况。PLS-DA是一种有监督的模式识别方法,一般用来建立组间的预测模型,判别多维变量在组间是否存在明显的差异。在本研究中,我们应用软件中默认的7轮交互验证方法以防止模式的过度拟合。我们应用独立T检验来比较组间均值是否存在显著差异,正常vs模型显著性差异的标准设为p<0.01,而柴黄益肾颗粒和福辛普利治疗前后的显著性差异标准为p<0.05。我们计算了每个差异变量相应的倍数变化,以显示它们在模型组以及治疗前后的变化程度。
代谢物鉴定是通过用NIST MS search 2.0软件比较质谱碎片与NIST 08标准质谱库(相似度超过70%)并最终用标准品验证的。
UPLCtofMS数据
UPLCtofMS ES+和ES-分析获得的原始数据由MarkerLynx Applications Manager version 4.1 进行提取。MarkerLynx的参数设定为:
每个测到的峰强度形成列表,由保留时间和m/z组成的数据对作为该离子的指征。所得三维矩阵包括峰指征(保留时间-m/z对),样品名称和离子强度。为了排除噪音的干扰,所得数据按照30%原则进一步去除缺失值(离子强度=0)在正常和模型样本中超过30%的变量。内标峰同样也要被去掉。
所得数据像GCtofMS数据一样经归一化并导入SIMCA-p 11.5进行多元统计分析。除了独立T检验(临界p-value设定与GCtofMS数据相似),由PLSDA模型计算得到的变量重要性参数(VIP)也被用来判断变量对模型组与正常组之间的差异是否具有显著贡献,其最小临界值设为1。只有同时满足VIP>1和p<0.01(T检验)的变量,才确定为模型组与对照组间的差异变量。
代谢物鉴定是通过与自建的标准品库及其他网络数据库(如HMDB,pubchem, metlin and lipidmaps等)比较质谱获得的精确质量数与和保留时间来推断的。
2.5.2脂质组学数据处理及结构鉴定[16]
UPLCMS数据
数据提取方式与UPLC-tofMS部分描述的相似,但由于UPLC-MS为只有单位质量数的分辨率,因此MarkerLynx的参数设定略有区别,而且脂质的鉴定除结合LCtofMS分析提供的各个峰的精确质量数外,必须结合正负离子模式、源内CID提供的特征碎片等信息并对照互联网上的一些专业数据库,比如HMDB, Lipidmaps, pubchem和metlin等,进行检索判断。
MSMS数据
MSMS数据的提取由Masslynx工作站软件自行读取。所得数据仅采用独立T检验进行统计分析。
2.6其它数据分析 血生化指标、尿蛋白等常规指标组间比较采用独立T检验法,在EXCEL2003中完成。数据以平均值±SD形式表示,P<0.05有统计学意义。
3.结果
3.1 传统指标及肾组织病理的改变 代表性PAS及体重、血糖、24小时尿蛋白、血生化等参数在空白、模型和福辛普利及柴黄益肾颗粒组的变化已在以前的研究结果中提及[16-17]。简单地说,福辛普利治疗可以显著降低模型组动物的甘油三酯、胆固醇和24小时尿蛋白水平,升高其血清白蛋白水平,但对血糖、总蛋白、血尿素氮、体重和肾重指数无显著影响。柴黄益肾颗粒治疗可以显著降低模型动物的24小时尿蛋白水平,对甘油三酯和胆固醇亦有降低趋势(p=0.08和0.06)。各组间血肌酐水平无统计学差异。中药+对照组各指标与假手术组无显著差异(数据未显示)。柴黄益肾颗粒和福辛普利治疗均能显著减轻肾小球和小管结构的改变。中药干预对假手术组的肾组织病理无显著影响(数据未显示)。
3.2 总体样本整体代谢表达谱的偏最小二乘判别分析
GCtofMS代谢指纹谱分析得到的色谱图,通过数据读取软件,转换成三维矩阵(样品×变量×强度)。经过数据处理和鉴定等工作,我们提取到了超过600个特征变量(用保留时间(retention time)和质荷比(m/z)表示),通过自建标准品库(Sigma–Aldrich, USA)及商业化合物数据库(NIST、NBS、Wiley等)鉴定了其中的120个代谢物。为了使组间的整体代谢差异可视化,我们对全部样品的数据进行了PLSDA判别分析。葡萄糖是糖尿病的重要生化指标,且浓度很高,必然对模型分组产生明显影响。为了减少葡萄糖的影响,使判别模型更好的反映非葡萄糖代谢物的贡献,我们从数据中去除了几个鉴定为葡萄糖的变量,然后再进行后续的数据分析。在去除了内标对应的几个变量后,我们将归一化处理的数据导入Simca-P 11.5 (Umetrics, Umeå, Sweden),进行多维统计分析。数据经中心化 和Parto前处理后,我们利用Simca-P成功建立PLSDA模型。建好的PLSDA模型的得分图显示在图1(A)中。如图所示,模型组和空白组在一维上即得到完全分离,这表明DN大鼠肾皮质的基于GCtofMS的整体代谢表达谱与空白组有显著差异。空白+中药组与空白组没有明显分离,因此表明中药本身未对代谢表达谱(基于GCtofMS)产生明显的影响。而柴黄益肾颗粒和福辛普利治疗组与模型组比较均没有明显分离,仅表现出一定的向空白组回归的趋势,柴黄益肾颗粒治疗相对于福辛普利来说这种趋势更明显一些,这表明DN相关的代谢异常可能被柴黄益肾颗粒和福辛普利治疗改善,而柴黄益肾颗粒的这种改善效果较福辛普利更明显。
类似地,对于LCtofMS分析得到的代谢指纹色谱图,我们用Markerlynx将其转化为三维数据矩阵(样品, 变量和峰高)。如果某个变量在模型组和对照组总样品数中出现0的比例超过70%,则该变量被认为是噪音而剔除。数据在Simca-P 中构建PLSDA模型前,也经过内标扣除、归一化及中心化、Parto前处理。ES-和ES+模式所得数据的PLSDA得分图见图1B和1C)。与GCtofMS的结果相比,我们可以观察到类似的组间聚集情况。有区别的是,ES-的PLSDA结果显示柴黄益肾颗粒和福辛普利治疗均有较明显的回调作用。而ES+的PLSDA结果则显示福辛普利治疗改善效果较明显。
对于UPLC-TOFMS脂质组分析得到的指纹色谱图,我们采用与基于UPLC-TOFMS的代谢指纹谱同样的数据分析方法。ES- 和ES+模式所得数据的PLSDA得分图见图1D和1E。PLSDA结果表明,表明DN大鼠肾皮质的基于LCMS ES+/-的脂质表达谱较空白组有显著差异,中药本身也未对代谢表达谱(基于LCMS脂质组指纹谱)产生明显影响。福辛普利和柴黄益肾颗粒治疗组均明显向空白组靠拢,提示两者治疗在一定程度上均能回调紊乱的脂质代谢状态;但福辛普利治疗组较柴黄益肾颗粒治疗组更接近于空白组,提示对于脂质代谢物来说,福辛普利的改善效果较柴黄益肾颗粒更明显。ES-与ES+模式的PLSDA得分图比较,福辛普利治疗组在ES+模式下更接近于对照组,并且已经于模型组明显分离,这可能提示福辛普利比柴黄益肾颗粒更能改善一些诸如磷脂酰胆碱类的易于在ES+模式下电离的脂类代谢物。
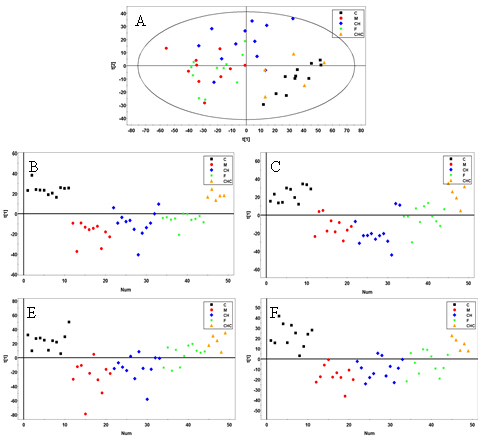
图1 总体样本整体代谢表达谱的PLSDA
A, B, C依次为GCtofMS、UPLC-TOFMS ES- 和UPLC-TOFMS ES+分析所得代谢组数据的PLSDA结果;D, E分别为UPLC-TOFMS ES- 和UPLC-TOFMS ES+分析所得脂质组数据的PLSDA结果;其中,C-空白组;M-模型组;CH-柴黄益肾颗粒组;F-福辛普利组;CHC-空白+中药组。
3.3 反映糖尿病肾病代谢表型的差异代谢物的鉴定
基于GCTOFMS和LCTOFMS的代谢指纹谱及基于LCMS的脂质指纹谱反映的DN差异代谢物的鉴定结果已另文发表[16-17]。基于MSMS的PA和PS代谢轮廓分析鉴定的DN差异脂质成分如表2所示。
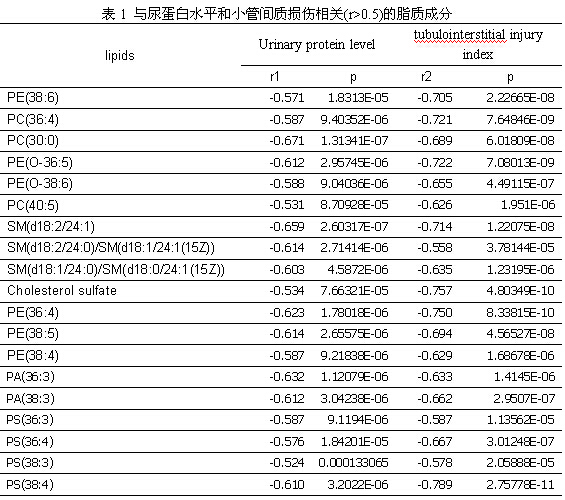
除了一系列差异代谢物与DN进展有密切相关性[16],部分差异脂质成分也表现了一定的相关性。表1中所列脂质与尿蛋白水平及小管间质损伤程度均为负相关,即伴随着DM肾损伤的进展,肾皮质中的许多脂质(一些PC、PE、PI、PA、PS及SM等)表现出减少的趋势。
3.4柴黄益肾颗粒干预对DN大鼠代谢表型的影响
以前述鉴定的差异代谢物作为评价药物治疗作用的指标,观察柴黄益肾颗粒及其对照药福辛普利对大鼠DN相关的异常代谢表达的影响。柴黄益肾治疗组的DN相关差异代谢物水平分别与模型组进行独立T检验。满足 p<0.05且可鉴定的代谢物的结果列于表2中。结果显示,柴黄益肾颗粒和福辛普利治疗都对许多异常代谢表现出明显的回调作用,总体来说,柴黄益肾颗粒对二(多)碳羧酸、羟酸、葡萄糖、尿毒素分子改善作用明显,而福辛普利治疗则对氨基酸、羟酸、非葡萄糖类糖、酰基肉毒碱及尿毒素分子回调明显。两者治疗影响的差异代谢谱虽然不完全一样,但对几个重要的差异代谢物却表现了相似的影响,比如马尿酸, 2-Phenylethanol glucuronide, 2,8-Dihydroxyquinoline-beta-D-glucuronide /3-Indole carboxylic acid glucuronide(同分异构体), 6-Hydroxy-5-methoxyindole glucuronide/ 5-Hydroxy-6-methoxyindole glucuronide(同分异构体). 其它一些在两种治疗作用中表现相同回调趋势的代谢物有:malic acid, 2-hydroxyacetic acid (Glycolic acid), 4-Hydroxybutyric acid, L-Threitol, methyl-πD-mannopyranoside,mannose. 一些代谢性差异代谢物在各组间的含量分布进一步以柱状图的形式表示(图2)。
表 2 柴黄益肾颗粒和福辛普利治疗影响的DN相关差异代谢物
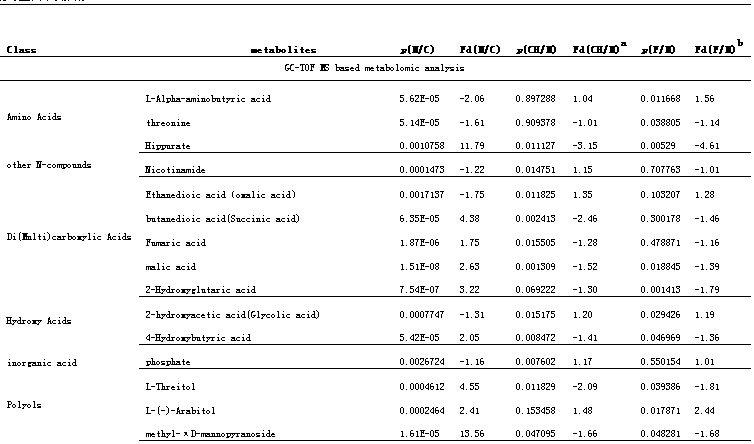
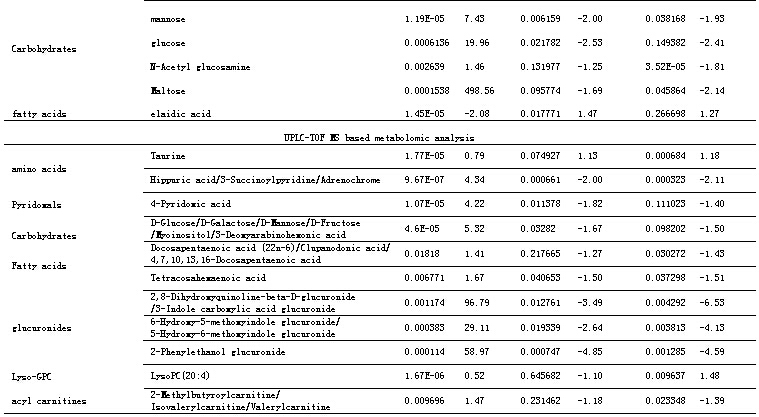
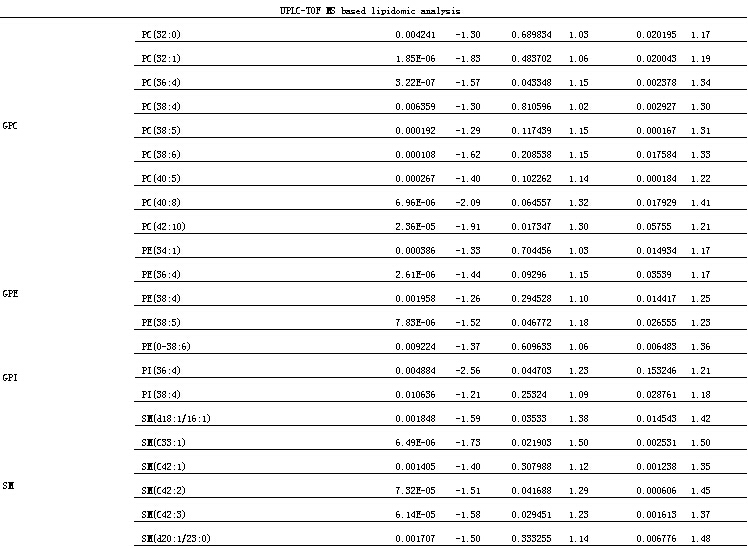
aFd(CH/M)是仪器测得的柴黄益肾颗粒组和模型组的代谢物平均相对强度的比值,‘+ ’和‘- ’分别代表该代谢物在治疗组中升高和降低。
bFd(F/M)是仪器测得的福辛普利组和模型组的代谢物平均相对强度的比值,‘+ ’和‘- ’分别代表该代谢物在治疗组中升高和降低。
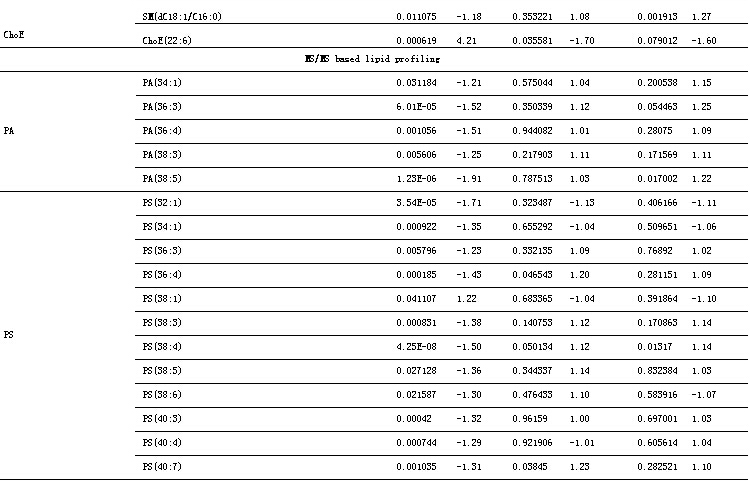
类似地,以差异脂质代谢物作为评价药物治疗作用的指标,观察柴黄益肾颗粒及福辛普利对大鼠DN相关异常代谢表达的影响。柴黄益肾治疗组及福辛普利治疗组的DN相关差异脂质代谢物水平分别与模型组进行独立T检验。满足 p<0.05且可鉴定的脂质代谢物的结果列于表2中。结果显示,柴黄益肾颗粒和福辛普利治疗都对许多异常代谢表现出明显的回调作用,总体来说,福辛普利比柴黄益肾颗粒能够更有效地回调多种脂质代谢物,包括PC、PE、SM等。柴黄益肾颗粒虽然在改善PC、PE上明显不如福辛普利,但其对SM、PA和PS的改善作用与福辛普利相差不大。一些代表性差异代谢物在各组间的含量分布进一步以柱状图的形式表示(图2)。
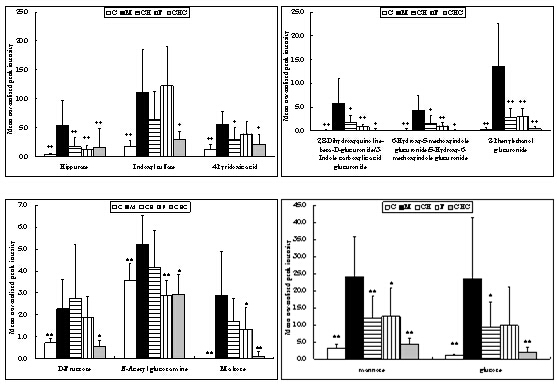

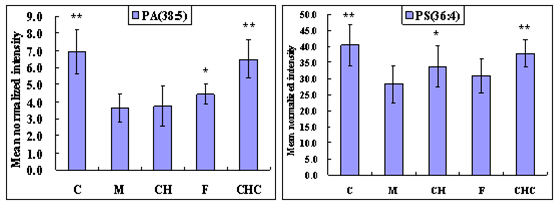
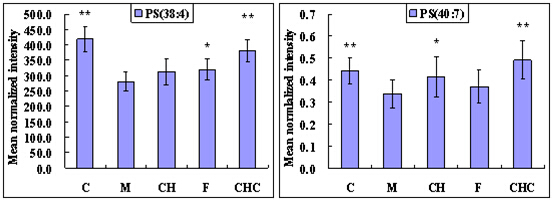
图2 能够被柴黄益肾颗粒或福辛普利治疗回调的代谢物相对强度分布柱状图
C-空白组;M-模型组;CH-柴黄益肾颗粒组;F-福辛普利组;CHC-空白+中药组。数据以平均值±SD形式表示,*p<0.05, **p<0.01, vs模型组.
4.讨论
肾皮质是肾脏的重要组成部分,因此皮质中一些小分子代谢物的异常很可能与糖尿病肾病的发生发展密切相关。本试验被设计来寻找与糖尿病肾病相关的肾皮质中小分子代谢物的异常变化,探讨糖尿病肾病的发病机理,并通过观察柴黄益肾颗粒和福辛普利治疗对异常代谢表达谱的影响,研究其治疗DN的作用机理。为了扩大代谢视窗,我们在数据采集时创新性地应用了两个子平台(代谢组和脂质组)整合的平台技术;为了减少血液对测定结果的影响,我们在组织取材时采用了活体灌流的方式。与空白组相比,DN组皮质中异常表达的代谢物,包括氨基酸、糖类、多元醇、溶血磷脂,有机毒素分子, 葡糖糖苷酸类、PC、PE、PS、PA、SM、TG及其它重要的但未能鉴定的代谢物等。柴黄益肾颗粒和福辛普利治疗都可以延缓DN进展,可能与其对一些差异代谢物的调节有关。
4.1柴黄益肾颗粒对DN大鼠肾皮质尿毒素和葡萄糖苷酸代谢异常的调节作用
之前的研究中,我们发现肾皮质中尿毒素和葡萄糖苷酸代谢异常与大鼠DN进展具有显著的相关性。本研究中,我们发现应用柴黄益肾颗粒和福辛普利干预可以使肾皮质多数有机离子水平明显下降(其中包括尿毒素和未能鉴定的有机酸分子等),同时蛋白尿和小管间质损伤有相应程度的缓解。我们推测调节有机毒素在肾脏中代谢或排泄影响相关的上下游途径可能是柴黄益肾颗粒和福辛普利发挥对DN大鼠的肾保护作用的一种重要机制。Merlin C. Thomas[24-25] 报道ACEI可以通过上调OCT以及小管有机离子清除率延缓DN进展,可见ACEI对小管功能有一定的保护作用。因此,我们进一步推测可能是因为这种保护作用,降低了有机离子在小管中的积聚,从而降低了肾皮质中有机毒素离子的水平,进而缓解了小管间质损伤程度和降低了蛋白尿水平。ACEI的这种药理机制可能为其延缓糖尿病肾病的非降压依赖作用机制研究提供新的线索。而柴黄益肾颗粒可能也具有类似的药理机制。柴黄益肾颗粒和福辛普利干预的结果,恰好从不同的角度进一步证明了这些能够被回调的差异代谢物与DN进展之间的关系。但柴黄益肾颗粒和福辛普利都不能回调显著升高的毒性物质吲哚磺酸,可能预示着不同的毒素在肾脏中有着不同的转运机制,柴黄益肾颗粒和福辛普利治疗不能影响到全部的机制,因而不能对全部毒素有效。
本研究对DN的临床治疗有一定的提示作用,应注意对DM或DN早期患者的肾小管功能进行保护,可能越早使用吸附剂或ACEI或柴黄益肾颗粒越能延缓DM进入DN。目前,已经有两篇文献提倡并通过临床试验证明对于DM患者吸附剂应尽可能早期干预[26-27]。
4.2柴黄益肾颗粒和福辛普利对脂质的调节作用
脂质代谢紊乱与DM发生发展的关系早已引起人们的关注[28],但至今不能明确其是否影响DN的进展。近年来,已陆续有学者开展了实验DM动物模型肾脏器官或组织水平上的脂质变化规律的研究。我们之前的研究表明,部分磷脂和鞘脂代谢异常与DN进展之间有显著的相关性。柴黄益肾颗粒和福辛普利干预对脂质代谢异常均有一定的改善作用。两者对PA和PS的影响都较小,对SM的影响都比较大(福辛普利略好于柴黄益肾颗粒),而对其它脂类,尤其是PC、PE,福辛普利的调节能力明显优于柴黄益肾颗粒。因此,针对鞘脂代谢通路相关酶的调节可能是柴黄益肾颗粒和福辛普利共同的作用机制。同时,福辛普利还可作用于调节磷脂尤其是PC和PE代谢通路相关的靶点。
4.3柴黄益肾颗粒和福辛普利作用机制的比较及总结
从生化指标、病理学结果及分子量在500amu以下的小分子代谢组分析结果看,柴黄益肾颗粒和福辛普利的治疗效果无显著差异,但从脂质组分析结果看,柴黄益肾颗粒对STZ诱导的DN大鼠肾皮质的脂质代谢异常的改善作用不如福辛普利。因此,总体来说,柴黄益肾颗粒虽然对DN有明显的疗效,但其对生理状态的调节要略逊于福辛普利。
另一方面,试验结果表明柴黄益肾颗粒和福辛普利改善的代谢谱存在明显的交叠。这提示我们柴黄益肾颗粒(包括其它一些治疗DN的中成药),可能与福辛普利有着某些共同的作用机制。比如,两者均可调节异常肾皮质中升高的有机酸尿毒素分子,说明柴黄益肾颗粒可能与ACEI一样,可能通过保护肾小管功能,减少毒素聚集,延缓DN的进展;两者均可升高异常降低的SM,说明两者可能均可通过改善鞘脂合成和代谢,发挥对肾脏的保护作用。根据本试验的结果和讨论,我们将柴黄益肾颗粒和福辛普利延缓DN进展可能的作用机制总结在图3中。
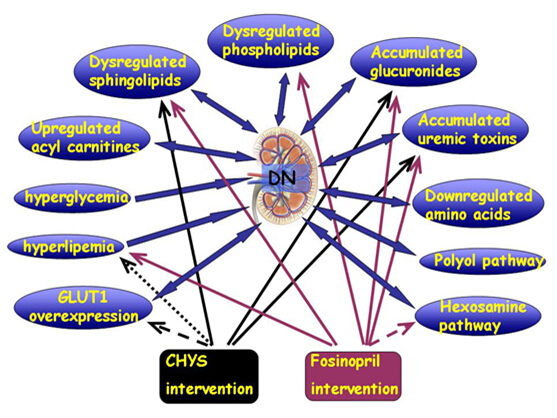
图3 柴黄益肾颗粒和福辛普利对DN大鼠保护作用的代谢相关机制总结
代表有变化的趋势,但无统计学上的显著性意义; 代表有统计学差异;
代表该途径某一个代谢物异常,且有统计学差异,但有待设计相关实验证明。
从整体代谢角度分析,柴黄益肾颗粒延缓DN进展可能与抑制肾皮质中积聚的有机毒素包括尿毒素和葡糖糖苷酸、调节鞘脂代谢紊乱以及下调过表达的GLUT1以及降低血脂等作用有关。福辛普利除与柴黄益肾颗粒同样地影响有机毒素、鞘脂代谢紊乱和降低血脂外,还可能具有改善磷脂代谢紊乱和调节己糖胺代谢通路的作用。
5.结论
本研究将建立的基于GCtofMS、UPLCtofMS和UPLCMS的肾皮质整合代谢组学平台被成功应用于柴黄益肾颗粒药物作用机制的研究。发现一些与DN进展相关的异常代谢物可以被柴黄益肾颗粒或福辛普利有效改善,这可能是柴黄益肾颗粒及福辛普利延缓DN进展的一种重要机制。特别地,柴黄益肾颗粒干预能够显著回调升高的有机毒素分子(包括尿毒素和葡糖糖苷酸物质)以及降低的鞘脂代谢物,这可能为其药理机制的研究提供新的线索。柴黄益肾颗粒和福辛普利对于DN的治疗,存在某些共同的作用机制,如回调有机酸尿毒素和鞘脂类代谢物;但柴黄益肾颗粒对于脂质组代谢异常的调节要逊于福辛普利。
参考文献
1. Soldatos, G. and M. Cooper, Diabetic nephropathy: important pathophysiologic mechanisms. DIABETES RES CLIN PR, 2008. 82: p. 75-79.
2. 张玉梅和康力, 糖脉康颗粒联合卡托普利治疗糖尿病肾病的临床随机对照试验. 中国实验方剂学杂志, 2011. 17(18): p. 251-253.
3. 张萌佳和张洁, 糖尿病肾病中医药临床研究进展. 中国实验方剂学杂志, 2009. 15(7): p. 95-96.
4. Rippin, J.D., A. Patel, and S.C. Bain, Genetics of diabetic nephropathy. Best Pract Res Clin Endocrinol Metab, 2001. 15(3): p. 345-58.
5. Cohen, C.D., et al., Improved elucidation of biological processes linked to diabetic nephropathy by single probe-based microarray data analysis. PLoS One, 2008. 3(8): p. e2937-e2937.
6. Choudhury, D., M. Tuncel, and M. Levi, Diabetic nephropathy--a multifaceted target of new therapies. Discovery medicine, 2010. 10(54): p. 406-415.
7. 马燕,等, 黄连相关中药复方治疗糖尿病及其并发症的研究概况. 中国实验方剂学杂志, 2011. 17(12): p. 272-275.
8. Bao, Y., et al., Metabonomic variations in the drug-treated type 2 diabetes mellitus patients and healthy volunteers. Journal of proteome research, 2009. 8(4): p. 1623-1630.
9. Li, H., et al., Pharmacometabonomic phenotyping reveals different responses to xenobiotic intervention in rats. Journal of proteome research, 2007. 6(4): p. 1364-1370.
10. Wikoff, W.R., et al., Metabolomics identifies perturbations in human disorders of propionate metabolism. Clinical chemistry, 2007. 53(12): p. 2169.
11. Zhang, J., et al., Metabonomics research of diabetic nephropathy and type 2 diabetes mellitus based on UPLC-oaTOF-MS system. Analytica chimica acta, 2009. 650(1): p. 16-22.
12. Xia, J.F., et al., Ultraviolet and tandem mass spectrometry for simultaneous quantification of 21 pivotal metabolites in plasma from patients with diabetic nephropathy. Journal of Chromatography B, 2009. 877(20-21): p. 1930-1936.
13. Xia, J.F., et al., Correlations of six related purine metabolites and diabetic nephropathy in Chinese type 2 diabetic patients. Clinical biochemistry, 2009. 42(3): p. 215-220.
14. Wenk, M.R., The emerging field of lipidomics. Nat Rev Drug Discov, 2005. 4(7): p. 594-610.
15. van Meer, G., Cellular lipidomics. EMBO J, 2005. 24(18): p. 3159-65.
16. Zhao, T., et al., Intrarenal metabolomics reveals the association of local organic toxins with the progression of diabetic kidney disease. J Pharm Biomed Anal, 2012. 60: p. 32-43.
17. 赵铁,张浩军,殷婷婷,路晓光,赵婷婷,李平, 柴黄益肾颗粒对糖尿病肾病大鼠保护作用的脂质组学研究. 中国实验方剂学杂志, 2012. 18(15): p. 155-162.
18. 洪晓华,等, 益肾颗粒对糖尿病肾病大鼠血清层黏连蛋白和Ⅳ型胶原含量的影响. 中国实验方剂学杂志, 2011. 17(22): p. 213-215.
19. 宫彩霞, 等, 芪丹益肾降糖胶囊对糖尿病肾病大鼠的保护作用. 中国实验方剂学杂志, 2010. 17(4): p. 140-143.
20. Li, H., et al., Transcriptomic and metabonomic profiling of obesity-prone and obesity-resistant rats under high fat diet. J Proteome Res, 2008. 7(11): p. 4775-83.
21. Laaksonen, R., et al., A systems biology strategy reveals biological pathways and plasma biomarker candidates for potentially toxic statin-induced changes in muscle. PLoS One, 2006. 1: p. e97.
22. Jonsson, P., et al., A strategy for identifying differences in large series of metabolomic samples analyzed by GC/MS. Analytical chemistry, 2004. 76(6): p. 1738-1745.
23. Jonsson, P., et al., High-throughput data analysis for detecting and identifying differences between samples in GC/MS-based metabolomic analyses. Analytical chemistry, 2005. 77(17): p. 5635-5642.
24. Thomas, M.C., et al., Reduced tubular cation transport in diabetes: prevented by ACE inhibition. Kidney international, 2003. 63(6): p. 2152-2161.
25. MT, G. and R. CT, Increased tubular organic ion clearance following chronic ACE inhibition in patients with type 1 diabetes. Kidney international, 2005. 67(6): p. 2494-2499.
26. Atoh, K., H. Itoh, and M. Haneda, Serum indoxyl sulfate levels in patients with diabetic nephropathy: Relation to renal function. Diabetes research and clinical practice, 2009. 83(2): p. 220-226.
27. Konishi, K., et al., AST-120 (Kremezin(R)) initiated in early stage chronic kidney disease stunts the progression of renal dysfunction in type 2 diabetic subjects. diabetes research and clinical practice, 2008. 81(3): p. 310-315.
28. 谷成英, 王爱华, 和曾艺鹏, 脂代谢紊乱对2 型糖尿病患者并发症合并症的影响. 中国现代医学杂志, 2009. 19(008): p. 1253-1256.
北京药学会 地址:北京市朝阳区北三环中路2号小二楼2层
本网站浏览52496114次
Copyright 2012 北京药学会( 本网站所有内容未经许可,不得以任何形式进行转载 ) All Rights Reservered