刘敬弢1,焦园园1,张艳华1*
1、北京大学肿瘤医院药剂科
l 摘要
【背景】新型抗体1B50-1可以通过结合细胞膜表面的钙离子通道α2δ1亚基(CACNA2D1)有效识别肝癌干细胞,因而有望成为新的靶向抗癌药物。
【方法】本研究以一对来源于同一患者的原发及复发肝癌细胞系(Hep11和Hep12)为研究对象,运用细胞增殖模型观察1B50-1抗体与阿霉素(ADM)、氟尿嘧啶(5-Fu)联用对两种肿瘤细胞的增殖抑制作用;利用流式分析技术和Real-time PCR技术比较两种细胞中CACNA的表达量差异;应用Western Blot方法探讨1B50-1抗体可能的作用机制。
【结果】细胞增殖实验发现,1B50-1抗体可以显著提高ADM和5-Fu对Hep12细胞的增殖抑制作用,但对Hep11细胞的影响不明显;流式分析结果显示,Hep12细胞中CACNA的含量(94.2%)明显高于Hep11细胞(0.7%);Western Blot证实Hep12细胞中CACNA和ABCG2的含量均较高,而Hep11细胞中几乎不表达;Realtime PCR实验表明,Hep12细胞中CACNA和ABCG2的含量是Hep11细胞中的278.2和5.6倍。
【结论】综上所述,本文发现针对肝癌干细胞的1B50-1抗体有可能通过降低耐药基因的表达提高化疗药的抑瘤作用,从而为临床抗癌用药提供新的思路。
l 关键词
肝癌干细胞,1B50-1抗体,细胞增殖,联合用药,肿瘤耐药
肝癌是我国发病率(第4位)和致死率(第2位)均较高的恶性肿瘤之一[1],具有易转移、易复发、预后差等特点。由于肝癌的耐药性明显,化学治疗现已不推荐单独使用。除了与手术、介入、基因治疗等手段配合使用外,化疗药物与分子靶向药物的联合应用逐渐成为肝癌药物治疗的新热点[2]。
癌症联合用药旨在降低肿瘤细胞的耐药性,提高化疗药物的抑瘤作用。在有关肿瘤耐药的机制研究中,肿瘤干细胞学说独树一帜并取得一系列成果。该学说认为,肿瘤组织中存在一类具有干细胞性状的肿瘤细胞——肿瘤干细胞[3]。这类细胞虽然在肿瘤细胞中只占有很小的比例,但具有低分化、高致瘤、高转移的特点,而且能以药物靶标突变、抗凋亡和增强药物外排等方式产生对化疗药物的抗性。有报道显示,具有干细胞特性的CD133+肝癌细胞比CD133-肝癌细胞的耐药能力明显增高[4]。因此,把经典化疗药物与作用于肿瘤干细胞的分子靶向药物联合应用,其疗效会优于单一的化疗。
我院细胞生物学实验室在前期研究中成功建立一对原发和复发肿瘤细胞系——Hep11和Hep12细胞,并据此发现一种可通过细胞表面钙离子通道α2δ1亚基(CACNA2D1)识别肝癌干细胞的新型抗体1B50-1[5]。其中,Hep11细胞来源于一名肝癌患者的原发肿瘤组织,而Hep12细胞来源于该患者经过化疗后复发的肿瘤组织。实验证实,经1B50-1抗体识别的α2δ1+细胞(Hep12细胞)亚群具有明显干细胞特性,α2δ1+细胞比α2δ1-细胞(Hep11细胞)的致瘤性更高,自我更新能力更强,癌旁组织中α2δ1+细胞的染色水平与肝癌患者预后相关[6]。然而,有关1B50-1抗体与化疗药物联合应用的研究尚未开展。本文旨在为临床抗癌用药提供新思路,以细胞生物学实验室建立的Hep11和Hep12细胞为研究对象,观察1B50-1抗体与临床常用的肝癌化疗药物阿霉素(Adriamycin, ADM)和氟尿嘧啶(Fluorouracil, 5-Fu)联用后对细胞增殖的影响,并初步探讨可能的分子机制。
1、材料方法
1.1、细胞培养
肝癌细胞系Hep11和Hep12由我院细胞生物学实验室提供,用含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的1640完全培养基,在37℃、含5%CO2的恒温恒湿培养箱中培养。
1.2、药品与试剂
抗体1B50-1由我院细胞生物学实验室经差减免疫法合成,ADM和5-Fu购于我院药剂科,分别由天津金耀药业有限公司和深圳万乐药业有限公司生产。
实验用RPMI 1640培养基、胎牛血清、青霉素、链霉素、WST-1细胞增殖试剂盒、一步法逆转录试剂盒(M-MLV)购于Invitrogen公司;鼠一抗CACNA,兔一抗ABCG2、GAPDH,山羊抗鼠及抗兔二抗由Epitomics公司生产;其他试剂及耗材购于我院供应科。
1.3、细胞增殖实验
取对数生长期的Hep11和Hep12细胞,用1640完全培养基配成浓度为1×105个/mL的细胞悬液,分别铺于96孔板内,90 μL/孔。将培养板置于温箱中培养24 h后,分别向每孔加入10 μL PBS、不同浓度的5-Fu(0.5, 1, 2和4 mmol/L)、ADM(0.01, 0.1, 1和10 μmol/L),同时加入或不加1B50-1抗体(20 μg/mL)。继续培养48 h后向每孔加入10 μL WST-1染料,用酶标仪测定各孔吸光度值(即OD值,激发光波长485 nm)。IC50值由IC50计算器计算,抑制率计算公式如下:
抑制率=(PBS组平均OD值-给药组平均OD值)/ PBS组平均OD值 × 100%.
1.4、流式分析
将1×105个Hep11和Hep12细胞分别接种于100 mm平皿中37 ℃培养24 h,经胰酶消化、PBS洗涤后收集细胞沉淀,CACNA鼠一抗37 ℃孵育1 h,PBS洗涤,FITC羊抗鼠二抗37 ℃孵育1 h,PBS洗涤后再加入100 μL PBS重悬细胞,两种细胞均设自身阴性对照,即只孵育二抗未孵育一抗。最后用流式细胞仪上机检测Hep11和Hep12细胞的荧光强度,并利用BD公司的Accuri C6软件分析细胞中CACNA的表达量,阳性率计算公式如下:
阳性率=(样品组阳性细胞数 / 样品组总细胞数 – 对照组阳性细胞数 / 对照组总细胞数)×100%。
1.5、Western Blot
细胞接种及收集同流式分析,细胞沉淀经PBS洗涤后各加入300 μL RIPA裂解液,冰上裂解30 min,再加入等体积的2×上样缓冲液煮沸5 min制成待测样品。制备聚丙烯酰胺凝胶,分别取10 μL样品上样,恒流20-40 mA电泳;用湿转法恒流电转至PVDF膜,75 V,90 min,5%脱脂奶粉封闭,4 ℃过夜。室温孵育一抗1 h(CACNA鼠抗,ABCG2、GAPDH兔抗,均为1:2000稀释),PBS洗涤10 min×3次,加入羊抗鼠或羊抗兔二抗室温孵育1 h(均为1:100000稀释),PBS再次洗涤10 min×3次,加入显色剂3 min,暗室曝光。
1.6、Realtime PCR
细胞接种及收集同流式分析,细胞沉淀经PBS洗涤后运用Trizol法提取总RNA,再按照M-MLV逆转录试剂盒的操作方法将RNA逆转录成cDNA。Realtime PCR反应体系为:Sybegreen 10 μL,模板cDNA 1 μL,引物0.5 μL,H2O 8.5 μL;反应参数为:预变性95 ℃ 5 min,扩展94 ℃ 1min / 60 ℃ 45 s / 72 ℃ 1 min共计40个循环,延伸72 ℃ 10 min。最后用Life technologies公司的Applied Biosystems 7500软件分析CACNA在Hep11、Hep12细胞中的含量并比较二者差异。引物序列如下:
CACNA2D1: 正义链:5'-ACAGCAAGTGGAGTCAATCA-3',
反义链:5'-ACTGCTGCGTGCTGATAAGA -3';
ABCG2 : 正义链:5'-GGAGGCCTTGGGATACTTTGAA-3',
反义链:5'-GAGCTATAGAGGCCTGGGGATTAC-3';
GAPDH: 正义链:5'-GACCCCTTCATTGACCTCAAC-3',
反义链:5'-CTTCTCCATGGTGGTGAAGA-3'
1.7、统计分析
实验结果运用Excel 2007和上述专业软件进行统计学分析。
2、实验结果
2.1、细胞增殖实验
首先观察ADM和5-Fu在单用和联用1B50-1抗体时分别对Hep11和Hep12细胞的增殖抑制作用。结果如表1及图1-2所示,单用ADM和5-Fu时,Hep12细胞中的IC50值高于Hep11细胞;而联用1B50-1抗体后,药物对Hep12细胞的抑制率明显上升,但对Hep11细胞的抑制率变化不大。
表1、ADM和5-Fu对Hep11和Hep12细胞的增殖抑制率
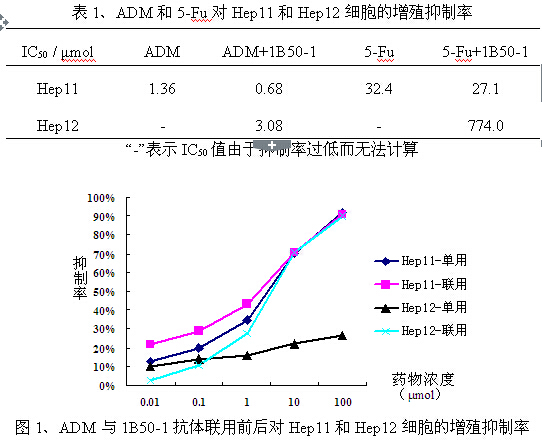
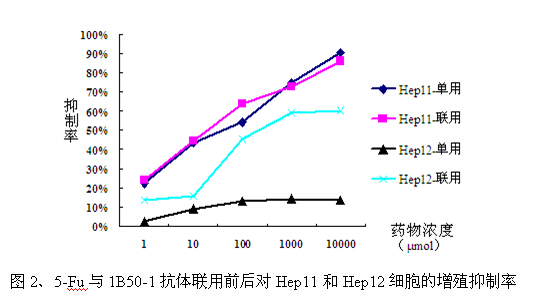
2.2、流式分析
图3结果表明,Hep11细胞中的CACNA含量仅为0.7%(图中绿色标记),而Hep12细胞中的CACNA含量高达94.2%。
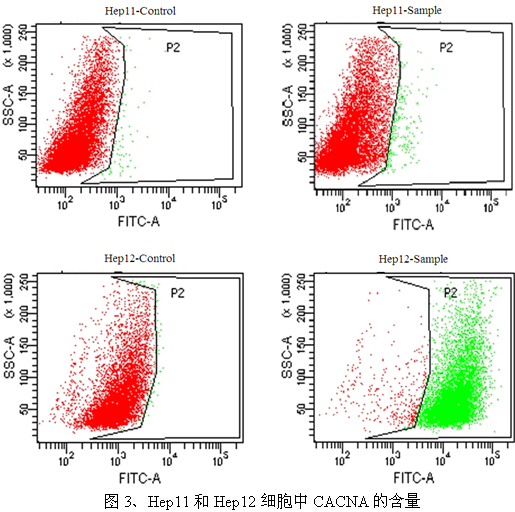
2.3、Western Blot
Western Blot结果如图4所示,以GAPDH蛋白为内参,Hep12细胞中CACNA和ABCG2的蛋白表达量均较高;而在Hep11细胞中ABCG2的表达量较低,CACNA则几乎不表达。
Hep11 Hep12
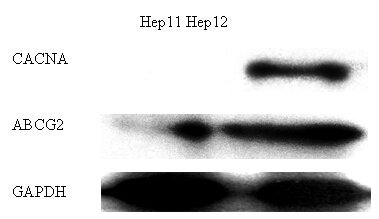
图4、Hep11和Hep12细胞中CACNA和ABCG2的蛋白表达
2.4、Realtime PCR
表2数据表明,Hep11细胞中CACNA和ABCG2的基因表达量均显著低于Hep12细胞,该结果与流式分析和Western Blot结果一致。
表2、Realtime PCR实验结果

3、讨论
耐药和毒副反应是癌症药物治疗的两大瓶颈,极大影响了抗肿瘤药物的疗效和癌症患者的预后;而耐药导致的用药剂量提高往往又是加重毒副反应的根源。如前所述,“肿瘤干细胞”理论的提出很好地解释了细胞耐药的发生机制,并且为人们研究逆转耐药提供了新的思路[2]。鉴于临床中复发肿瘤比原位癌更容易耐药的特点,本文以一对同源的原发和复发肿瘤细胞系为研究对象,首次证实了新型抗体1B50-1可以提高化疗药物对肝癌干细胞的抑制作用。
在前期研究中,我院细胞生物学实验室从同一位肝癌患者的原发和复发肿瘤组织中建立出Hep11和Hep12两种细胞系,后者在自我更新、分化以及致瘤性等方面均呈现肿瘤干细胞特性而前者则无此特性[5-6]。同时,实验发现Hep12细胞的膜表面比Hep11细胞表达更多的钙离子通道受体CACNA,而新型抗体1B50-1可以与CACNA特异性结合从而降低Hep12细胞的干细胞特性,但对Hep11细胞影响不大[6]。因此,1B50-1抗体有望成为能够识别并抑制肿瘤干细胞的新型单克隆抗体。
为了探讨1B50-1抗体与化疗药物联用的效果,本实验首先建立细胞增殖模型,分别观察化疗药物与1B50-1抗体联用前后抑制肿瘤细胞增殖的效果,并且比较1B50-1抗体在Hep11和Hep12细胞系中对于提高化疗药物抑瘤率的差异。实验结果显示,化疗药物单用时,其IC50值在Hep11细胞中明显低于Hep12细胞,说明肿瘤干细胞比普通肿瘤细胞对细胞毒类药物的耐受性更高。联用1B50-1抗体后,化疗药的抑制率在Hep12细胞中明显升高,但在Hep11细胞中变化不大。这表明1B50-1抗体可以特异性地拮抗肿瘤干细胞,从而提高化疗药物的疗效,但对普通肿瘤细胞影响不大。
基于此,我们又进一步探讨了1B50-1抗体逆转化疗耐药可能的作用机制。流式分析、Western Blot和Realtime PCR实验均发现,Hep12细胞中CACNA2D1蛋白含量明显高于Hep11细胞。该蛋白已被证实是一种肝癌干细胞的标志物,而1B50-1抗体则是其特异性抗体。ABCG2是ATP结合盒(ABC)转运蛋白家族的一员,与肿瘤耐药密切相关[7]。Western Blot和Realtime PCR结果则进一步显示,Hep12细胞中ABCG2的表达量也明显高于Hep11细胞。上述结果表明,1B50-1抗体很可能是通过与肿瘤干细胞特异性受体CACNA2D1结合,抑制Hep12中ABCG2蛋白的表达,从而提高了化疗药物的抑制率;然而Hep11细胞中CACNA2D1和ABCG2蛋白含量均较低,故耐药性不明显,化疗药物联用1B50-1抗体前后的抑制率变化也不大。
4、结论
综上所述,我们的研究发现1B50-1抗体与化疗药联用能够增强后者对复发肝癌细胞的增殖抑制作用。这种作用可能与1B50-1抗体拮抗肝癌干细胞、降低耐药基因的表达有关,具体的机制以及体内研究还有待进一步深入。目前,将化疗药物与靶向药物联合应用已逐渐成为临床肿瘤用药的新模式,我们的发现可为联合用药提供新的思路。
致谢
本研究特别感谢北京肿瘤医院暨北京市肿瘤防治研究所细胞生物学实验室的张志谦老师和赵威老师对本研究的悉心指导和鼎力支持!
参考文献
[1] 2012中国肿瘤登记年报, 2013. 01, 国家癌症中心、卫生部疾病预防控制局.
[2] Gupta R, Vyas P, Enver T. Molecular targeting of cancer stem cells. Cell Stem Cell. 2009, 5(2): 125-126.
[3] Hamburger A.W., Salmon S.E. Primary bioassay of human tumor stem cells. Science, 1977, 197(4302): 461-463.
[4] Ma S., Lee T.K., Zheng B.J., et al. CD133+ HCC cancer stem cells confer chemoresistance by preferential expression of the Akt/PKB survival pathway [J]. Oncogene, 2008, 27(12): 1749-1758.
[5] Xu X.L., Xing B.C., Han H.B., et al. The properties of tumor-initiating cells from a hepatocellular carcinoma patient’s primary and recurrent tumor [J]. Carcinogenesis, 2010, 31(2): 167-174.
[6] Zhao W., Wang L.M., Han H.B., et al. 1B50-1, a mAb raised against recurrent tumor cells, targets liver tumor-initiating cells by binding to the Calcium channel α2δ1 subunit [J]. Cancer Cell, 2013, 23(4): 541-556.
[7] Fukuda Y., Schuetz J.D. ABC transporters and their role in nucleoside and nucleotide drug resistance. Biochem Pharmacol. 2012, 83(8):1073-1083.
附注
作者单位:北京肿瘤医院药剂科,北京市海淀区阜成路52号,邮编100142。
通讯作者:张艳华老师,88196206, zyh8812@163.com.
第一作者:刘敬弢,88196338, 13683582316, xyljt_1985@126.com.
北京药学会 地址:北京市朝阳区北三环中路2号小二楼2层
本网站浏览47476099次
Copyright 2012 北京药学会( 本网站所有内容未经许可,不得以任何形式进行转载 ) All Rights Reservered