覃鲁珊1,2‡,李奇1,马致洁1,3,赵艳玲1,张雅铭1,张萍1,鄢丹1,柏兆方1,赵奎君3,王伽伯1*,肖小河1*
解放军302医院·全军中医药研究所;2 江西中医药大学;3 首都医科大学附属北京友谊医院;
摘要: 目的 运用代谢组学方法对何首乌致肝损伤大鼠的尿液代谢差异进行表征,寻找潜在的生物标志物并探讨何首乌致肝损伤的作用机制。方法 采用液相色谱-质谱方法测定正常组大鼠尿液与何首乌组大鼠尿液的代谢指纹谱,利用多元统计分析方法比较两组的代谢谱差异,筛选出可能的潜在生物标志物,并作出相关代谢途径的可能解释。结果和结论 经比较分析,共筛选得到27个潜在生物标志物,这些重要的差异代谢物主要参与了氨基酸代谢、三羧酸循环和脂质代谢等相关通路。
关键词 :何首乌;肝损伤;代谢组学
Abstract: Differences between the characterization of urine metabolism in hepatopathy rats induced by Polygonum multifulorum was study which basing on metabonomics. In addition, searching the potential biomarkers and studying the mechanism of liver injury induced by Polygonum multifulorum. In this paper LC-MS method has carried on the analysis to metabolic fingerprint spectrum between treatment group and control group . Comparison the difference and screening the potential biomarkers which using the multivariate statistical methods. As well, metabolic pathway would be detailed description. The results show that twenty seven potential biomarkers were screened and these biomarkers involved amino acid metabolism, tricarboxylic acid cycle and lipid metabolism.
Key words: polygonum multiflorum; liver injury; metabonomics
何首乌始载于《开宝本草》, 为蓼科植物何首乌Polygonum multiflorum Thunb. 的干燥块根。其味苦、甘、涩,微温,具有补肝肾、益精血、乌须发、强筋骨、化浊降脂等功效[1]。然而,近年来国内外关于何首乌肝毒性的报道日渐增多[2-9]:如澳大利亚、英国、荷兰、哥伦比亚、意大利、韩国和中国香港等相继出现何首乌肝损害的病例报道,症状分别表现为轻重度黄疸、急慢性肝炎、肝功能异常等。前期,课题组对何首乌进行研究,发现在特定的人群中何首乌的肝毒性确实客观存在,进一步研究发现何首乌不止对肝脏有损伤,对肾和肺脏也有一定程度的损伤[10],但其毒性机制尚不明确。肝功能生化指标[11]是目前检测肝脏是否病变的主要参考指标,课题组前期研究发现谷丙转氨酶和谷草转氨酶对何首乌肝损伤不敏感[10],所以筛查出新的灵敏的何首乌肝损伤生物标志物对此类肝病的早期诊断与治疗具有一定的参考作用。
代谢组学(metabonomics)是研究外源性物质作用于机体后所有内源性代谢产物及其中间体种类、数量及其变化规律的新兴学科。代谢组学的主要研究材料有尿液、血液、各种分泌液及活检组织(如肝穿标本)等。目前,用代谢组学的方法和技术对血、尿、肝组织进行整合分析,在药物诱导的肝脏毒性研究中发挥着极其重要作用。
本研究采用液相色谱-质谱(LC-MS)仪器分析与数学解析相结合的代谢组学技术,考察正常大鼠尿液与何首乌致肝损伤大鼠尿液之间的代谢特征谱差异,结合代谢通路数据库,寻找与药物作用机制相关的代谢物和相应的代谢网络,探讨相关的药物作用机制,为何首乌致肝损伤疾病的早期诊断和治疗提供参考。
材料与方法
仪器 高效液相色谱(Agilent 1200 HPLC,美国Agilent公司)-四级杆飞行时间串联质谱仪(Bruker microTOF-QⅡ,德国 Bruker 公司),DataAnanlsis 工作站;Gradient A10 Mill-Q 超纯水器(法国 Millipore 公司);冷冻离心机(Sigma,德国);微量分析天平(Mettler Toledo AL204 瑞士);涡旋混匀器(HYQ 2121A)
药材与试剂 生首乌(批号:10050904)购于北京绿野药业有限公司,经解放军第三〇二医院肖小河研究员鉴定为蓼科植物何首乌(Polygonum multiflorum Thunb.)的干燥块根;制何首乌(批号:10122402)有上述同一批生首乌炮制而成,炮制方法参照《中华人民共和国药典(2010年版)》及《北京市中药材炮制规范》,由北京绿野药业有限公司协助完成。甲醇(色谱级,德国Merck公司)、去离子水经(18.2 MΩ) Millipore Milli-Q 系统(Millipore Co.,美国) 超纯水器净化,其他试剂为市售分析纯。
动物与分组 SD大鼠,SPF级,体重160 g左右,雄性,共36只,购于军事医学科学院实验动物中心(合格证号SCXK-军2007-004)。动物饲养于屏障动物房,室温(20±2)℃, 相对湿度60%~70%, 通风良好、环境安静, 室内保持12小时照明, 12小时黑暗, 并定期消毒。将实验动物SD大鼠随机分为3组,正常对照组、生首乌醇提物组和制首乌醇提物组,每组12只。给药剂量均为20 g生药/kg,按4 mL/200 g体重灌胃给药,正常对照组给予相同量蒸馏水,连续给药28天。给药期间动物自由饮食。最后一天取各组大鼠尿液,分装保存在-80℃冰箱中。
药品制备 本实验醇提物所采用的提取方法为:将生首乌和制首乌分别粉碎得粗粉,加6倍量的75%乙醇冷浸提取,共提取5次,每次48小时,最后合并醇浸提取液,浓缩并减压干燥,制得干粉备用。每次给药前按生药量折算配制药液,水浴加热至37 ℃时使用。
样品制备与处理 大鼠尿液于-80℃冰箱中取出,复融,取250μL加入到1.5mL EP管中,再加入750μL的甲醇溶液,混匀,静置,4 ℃冷冻离心(10,000 r/pm, 10 min),取上清,于0.22μm微孔滤膜进行滤过,备用。
LC-MS条件 色谱条件 色谱柱:Agilent ZORBAX SB-C18(5μm,2.1*150mm);流动相:A:CH3OH,B:H2O;流速:0.25 mL·min-1;进样量:20 μL;柱温:25℃;样品温度:4℃;检测波长:420nm;色谱梯度洗脱条件如表1。

质谱条件 离子源:ESI±;毛细管电压:3500V; 质量数:50道尔顿到1000道尔顿;碰撞能:7 eV;锥孔能:5 eV;脱溶剂气流量:6.0 L/min;脱溶剂气温度:180℃。
数据处理 采用德国布鲁克公司Bruker Daltonics工作站中自带的DataAnalysis和Mzmine软件进行色谱峰识别,再将数据导入SIMCA-P-11软件,标准化后进行主成分分析(PCA)和偏最小二乘法-判别(PLS-DA)分析。运用variable influence in the projection ( VIP)方法来预测各个代谢物对模型的贡献值,VIP>1说明具有明显的贡献,有统计学意义,为可能的潜在标志物,再采用one-way ANOVA的方法,根据P<0.05的原则,排除没有显著性差异的数据。通过这一系列步骤之后,将剩下的有意义的数据在Human Metabolome Database、KEEG数据库中进行匹配,并用标准品进行定位后,最终得到潜在的生物标志物。
结果
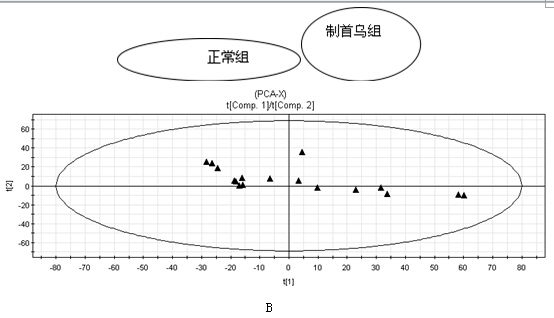
LC-MS色谱图 平行测定何首乌大鼠尿液与正常对照组大鼠尿液,得到LC-MS色谱图,如图1所示。何首乌组和正常组大鼠在第一主成分上实现了完全分离,组内样品较聚集,两组大鼠的尿液代谢物谱信息存在显著差异。
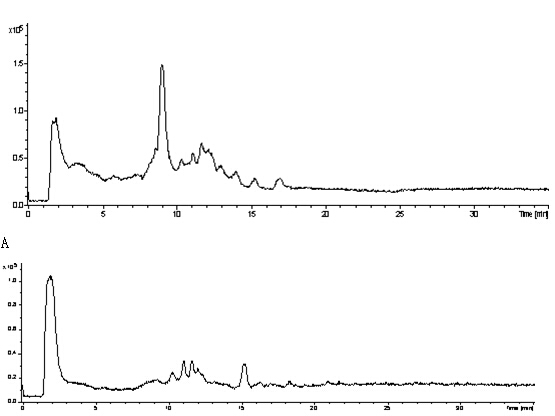
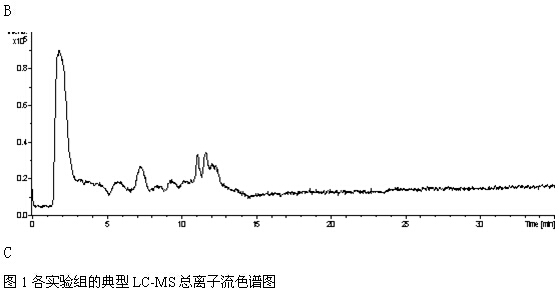
(A: 生何首乌给药组,B: 制何首乌给药组, C: 正常对照组)
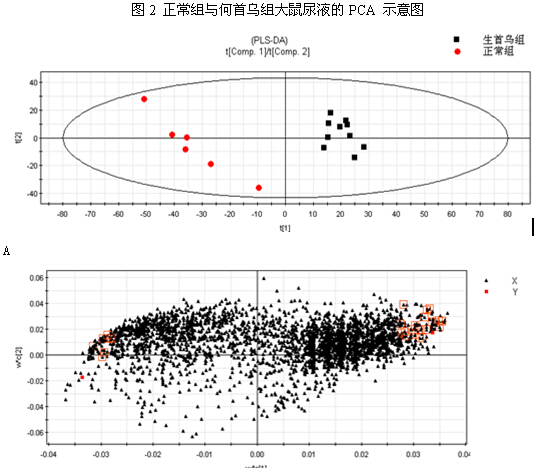
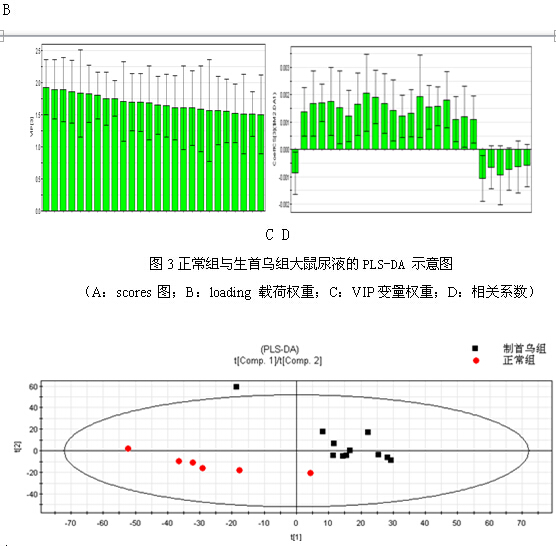
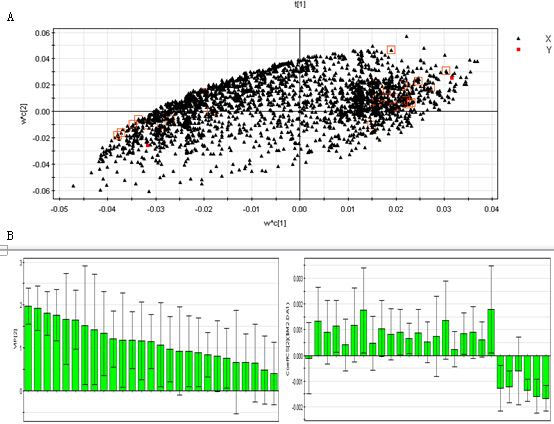
PCA与PLS-DA结果 首先对何首乌致肝损伤组和正常组进行了无监督模式的PCA,其得分如图2所示。结果显示何首乌致肝损伤组与正常组可以获得较好的分离,表明大鼠给予何首乌造成肝损伤后,生理代谢环境受到明显干扰,病理状态下代谢网络出现紊乱。为了区别更多的离子峰,又分别对生首乌和制首乌致肝损伤大鼠尿液与正常组尿液进行了PLS-DA分析,其得分矩阵投影图如图3、图4所示,可见何首乌致肝损伤组与正常组明显区分开来。在建立PLS-DA模型基础上,通过变量权重VIP值、载荷权重(loading weight)和相关系数(correlation cofficients)等多维统计分析指标筛选何首乌组与正常对照组之间的差异性变量。如图3B、4B所示,图中标红色方框的点远离原点,这些点所代表的化合物即为潜在的生物标志物。在线检索一些数据库,最终共筛选得到27个潜在的生物标志物,包括泛硫乙胺(Pantetheine)、Methyl bisnorbiotinyl ketone 、羟基皮质甾酮(18-Hydroxycorticosterone)、脱氧核糖磷酸(Deoxyribose 1-phosphate)和磷酸酰基甘油酮(Dihydroxyacetone Phosphate Acyl Ester)等,详见表2。
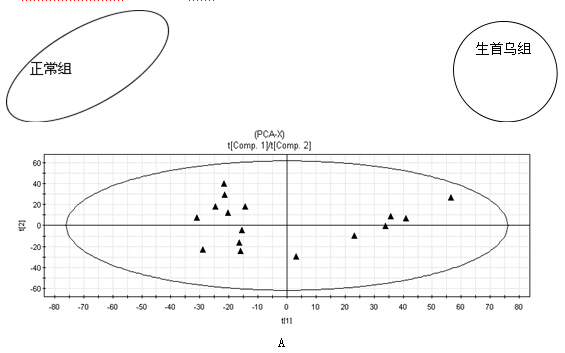
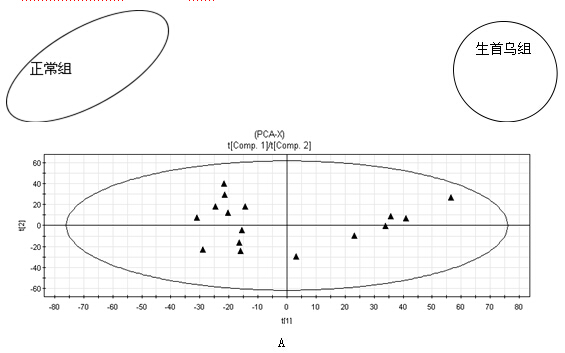
C D
图4 正常组与制首乌组大鼠尿液的PLS-DA 示意图
(A:scores 图;B:loading 载荷权重;C:VIP变量权重;D:相关系数)
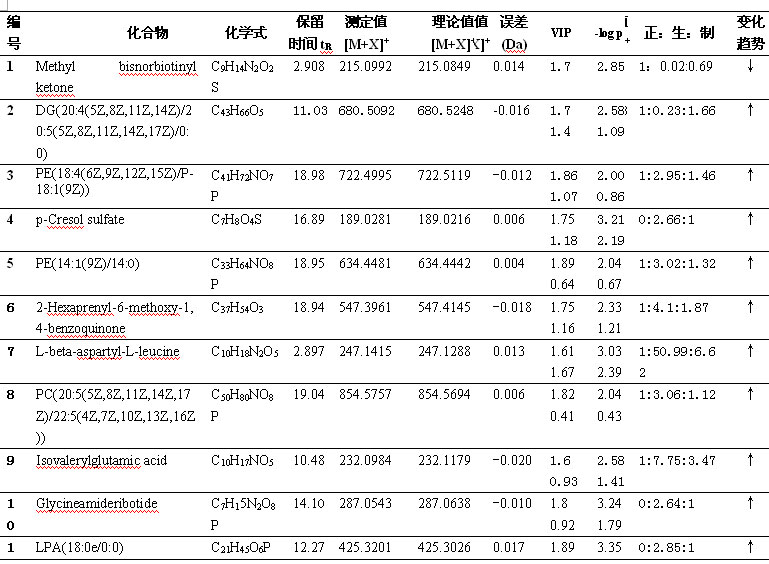
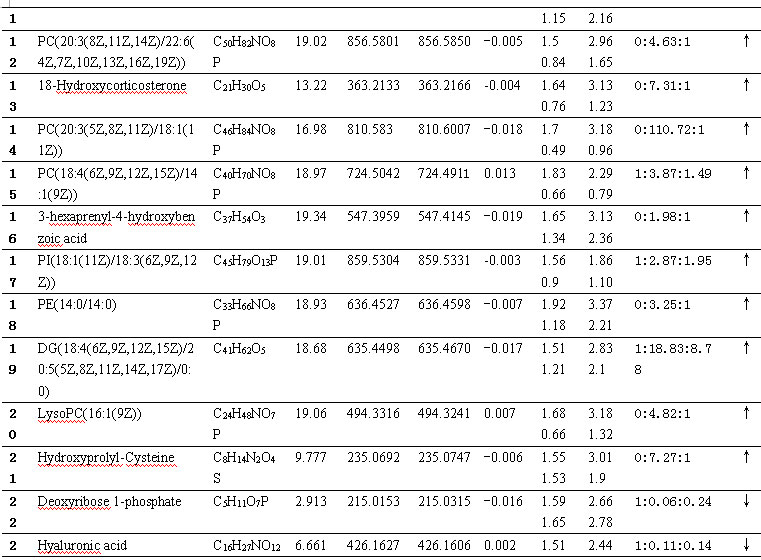

表2 筛选出的潜在的生物标志物
讨论
筛选出的27个潜在的生物标志物大致可分为磷脂类、氨基酸类、磷酸类、核苷酸类、多糖类、代谢相关中间物质等。
磷脂(Phospholipid),也称磷脂类、磷脂质,是含有磷酸的脂类,属于复合脂。磷脂组成生物膜的主要成分,分为甘油磷脂与鞘磷脂两大类,分别由甘油和鞘氨醇构成。人体所有细胞中都含有磷脂,它是维持生命活动的基础物质。磷脂对活化细胞,维持新陈代谢,基础代谢及荷尔蒙的均衡分泌,增强人体的免疫力和再生力,都能发挥重大的作用。如其中的磷酸酰基甘油酮[12](Dihydroxyacetone Phosphate Acyl Ester)是在甘油磷脂和脂质代谢通路中发现,其含量水平的异常表明体内脂质代谢通路紊乱。脂质的代谢包括脂类在小肠内消化、吸收,由淋巴系统进入血循环(通过脂蛋白转运),经肝脏转化,储存于脂肪组织,需要时被组织利用。
氨基酸(Amino acid)是构成蛋白质(protein)的基本单位,赋予蛋白质特定的分子结构形态,使它的分子具有生化活性。蛋白质是生物体内重要的活性分子,包括催化新陈代谢的酶。L-β-天冬氨酰基-L-亮氨酸(L-beta-aspartyl-L-leucine)、羟基脯氨酰基半胱氨酸(Hydroxyprolyl-Cysteine)、酰基甘氨酸(Suberylglycine)都是蛋白质代谢的分解产物。
尿液中本身含有磷酸类物质。本实验中筛选出的脱氧核糖磷酸[13](Deoxyribose 1-phosphate)是磷酸戊糖途径代谢通路的代谢物,其含量水平异常表明磷酸戊糖代谢途径发生紊乱,而磷酸戊糖途径是指机体某些组织(如肝、脂肪组织等)以6-磷酸葡萄糖为起始物在6-磷酸葡萄糖脱氢酶催化下形成6-磷酸葡萄糖酸进而代谢生成磷酸戊糖为中间代谢物的过程。
核苷酸类化合物参与了生物体内几乎所有的生物化学反应过程。核苷酸是核糖核酸及脱氧核糖核酸的基本组成单位,是体内合成核酸的前身物。核苷酸随着核酸分布于生物体内各器官、组织、细胞的核及胞质中,并作为核酸的组成成分参与生物的遗传、发育、生长等基本生命活动。甘氨酰胺核苷酸(Glycineamideribotide)是嘌呤核苷酸从头合成过程中的中间产物,通过激活葡萄糖-6-磷酸-脱氢酶,刺激促黄体激素(LH)和绒毛膜促性腺激素(HCG)而形成。
透明质酸(Hyaluronic acid)基本结构是由两个双糖单位D-葡萄糖醛酸及N-乙酰葡糖胺组成的大型多糖类。透明质酸本身带有负电荷,在动物体存在于大部分的软结缔组织中。它的水溶液为粘弹性流体,填充在细胞与胶原纤维空间之中且覆盖在某些表皮组织上。在动物体,其主要功能乃保护及润滑细胞,调节细胞在此粘弹性基质上的移动,稳定胶原网状结构及保护它免于受到机械性的破坏。
代谢是生物体内所发生的用于维持生命的一系列有序的化学反应的总称。这些反应进程使得生物体能够生长和繁殖、保持它们的结构以及对外界环境做出反应。泛硫乙胺(Pantetheine)是体内辅酶A代谢的中间体,其含量的异常改变会影响哺乳动物肝脏中辅酶A 的中间代谢通路[14] 。2-六异戊二烯基-6-甲氧基-1,4-苯醌(2-Hexaprenyl-6-methoxy-1,4-benzoquinone)存在于泛醌生物合成途径,泛醌最先由R.A.Morton从鼠肝脂质中分离出来的,在人体主要存在于肝、心、肾、肾上腺等组织。它在体内呼吸链中质子移位及电子传递中起重要作用,是细胞呼吸和细胞代谢的激活剂,也是重要的抗氧化剂和非特异性免疫增强剂。羟基皮质甾酮[15](18-Hydroxycorticosterone)与类固醇的生物合成代谢密切相关,类固醇代谢的异常可间接影响到体内胆汁酸和胆汁醇的变化,这也是某些肝脏疾病或胆道淤积病变的微观体现。
总之,本研究应用代谢组学方法对何首乌致肝损伤大鼠尿液与正常大鼠尿液中的差异代谢物进行研究,经比较分析,共得到27个差异代谢物,这些重要的差异代谢物主要参与了机体内三羧酸循环、脂质代谢等相关通路。本研究为阐明何首乌致肝损伤的复杂机制提供了参考,也为何首乌致肝损伤的早期诊断与治疗提供了思路。
参考文献
[1] 国家药典委员会. 中华人民共和国药典2010年版一部 [M]. 北京:中国医药科技出版社,2010:164-165.
[2] Hinshaw LB. Sepsis septic shock:Participation of the microcirculation:An abbreviated review[J] . Crit Care Med ,1996 ,24 9(6) :1072 – 1078.
[3] 国家食品药品监督管理局药品评价中心. 英国MHRA警告何首乌的肝损害不良反应[J]. 中国药物警戒,2006,3(5):313-314.
[4] Park GJH,Mann SP,Ngu MC. Acute hepatitis inducedby Shou Wu Pian,a herbal product derived from Polygonum multiforum [J]. J Gastroenterol Hepatol ,2001,16(1):115-117.
[5] Panis B,Wong D R,H ooymans P M. Recurrent toxic hepatitis in a Cau casian girl related to the use of Shou Wu Pian,a Chinese herb alpreparat ion [J]. J P ediatr Gastroenterol Nutr ,2005,41:256-258.
[6] Battinelli L, Daniele C, Mazzanti G. New case of acute hepatitis following the consumption of Shou Wu Pian, a Chinese herbal product derived from Polygonum mu lt iflorum [J]. Ann Intern Med, 2004, 140(7): 588-589.
[7] Cárdenas A,Rest repo J,Sierra F. Acute hepaitis due to Shen Min:a herbal product derived from Polygonum multiflorum [J]. J Clin Gas roenterol,2006,40(7):629-632.
[8] Min H J,Jung K A,Kim H . Twelve cases of toxic hepatitis related to the root of Polygonum multiflorum Thunb [J]. J Hepatol,2008,47:S356.
[9] But P P,Tomlinson B,Lee K L. Hepatitis related to the Chinese medicine Shou wu pian manufactured from Polygonum multiflorum [J]. Vet Hum Toxicol,1996,38(4):280-282.
[10] 李奇,赵奎君,赵艳玲,等.大剂量何首乌醇提物致大鼠多脏器损伤研究[J].环球中医药,2013,6(1):1-7.
[11] 孙蓉,杨倩,黄伟,等.肝功能相关指标在中药肝毒性损伤中作用与毒性相关程度分析[J].中药药理与临床,2008,24(6):82-84.
[12] Thai TP,Heid H,Rackwitz HR,Hunziker A,Gorgas K,Just WW. Ether lipid biosynthesis: isolation and molecular characterization of human dihydroxy acetonephosphate acyltransferase[J]. FEBS Lett,1997 ,420(2-3):205-11.
[13] Holmberg I,Stal P,Hamberg M. Quantitative determination of 8-hydroxy- 2'-deoxyguanosine in human urine by isotope dilution mass spectrometry: normal levels in hemochromatosis[J]. Free Radic Biol Med,1999,26(1-2):129-35.
[14] Mandel,Alexander L,La Clair, James J,Burkart,Michael D. Modular Synthesis of Pantetheine and Phosphopantetheine[J]. Organic Letters,2004,6(26):4801-4803.
[15] Peter M,Partsch CJ,Sippell WG. Multisteroid analysis in children with terminal aldosterone biosynthesis defects[J]. J Clin Endocrinol Metab,1995 ,80(5):1622-7.
作者简介:覃鲁珊 女 硕士研究生 专业:中药学
通讯作者:王伽伯,男,助理研究员,从事中药药性与毒性研究。E-mail: wjb0128@126.com , Tel/Fax:010-66933325。肖小河,男,研究员,博士生导师,从事临床中药学与合理用药研究。E-mail: pharmacy302@126.com , Tel:010-66933322, Fax:010-66933325。
北京药学会 地址:北京市朝阳区北三环中路2号小二楼2层
本网站浏览47475886次
Copyright 2012 北京药学会( 本网站所有内容未经许可,不得以任何形式进行转载 ) All Rights Reservered