[摘要] 目的: 系统评价多粘菌素E与其它抗菌药物联合的联合治疗方案(以下简称联合方案)与其单药治疗方案(以下简称单药方案)的有效性和安全性。方法: 计算机检索PubMed, Embase 和 Cochrane Library,查找其联合方案与单药方案的临床对照研究文献。检索时限截至到2013年5月,按纳入与排除标准筛选文献,采用RevMan 5.0 统计软件进行Meta分析。结果: 共纳入14篇相关文献,其中死亡率结果共纳入5篇文献,单药方案的死亡率显著大于联合方案的死亡率[OR=2.30,95%CI (1.28, 4.13),P=0.005];临床疗效共纳入11篇文献,总体结果显示,单药方案优于联合方案[OR=1.59,95%CI(1.03, 2.45),P=0.04],但亚组分析结果显示,前瞻性研究中,单药方案与联合方案没有显著差异[OR=1.02,95%CI(0.53, 1.94),P=0.96];微生物结果共纳入4篇文献,结果显示,单药方案与联合方案的微生物根除结果无显著差异[OR=1.25,95%CI(0.66, 2.36),P=0.50];肾毒性结果共纳入4篇文献,联合方案的肾毒性与单药方案的无显著差异[OR=0.90,95%CI(0.31, 2.61),P=0.85]。结论: 联合方案在临床结果和微生物根除结果与单药方案相当,但在提高患者生存率上,多药方案要优于单药方案。多药联合治疗不增加多粘菌素E的肾毒性。
[关键词] 多粘菌素E;单药治疗;多药治疗;鲍曼不动杆菌;绿脓杆菌;Meta分析
The Efficacy and Safety of Colistin Combination Therapy vs. Monotherapy: A Meta-analysis
LUO Jing1 , LEI Zhao-jin1, LI Zhong-dong1,2
(1 Clinical School of Air Force, Anhui Medical University, Hefei 230032, China; 2 General Hospital of Air Force, PLA, Beijing, 100142 China)
[Abstract] Objective: To evaluate the efficacy and safety of colistin in combination with other antibacterials(combination therapy) and its monotherapy(monotherapy). Methods: We searched clinical trials on comparing combination therapy with monotherapy from the Cochrane Library, Pubmed and Embase up to May 2013. System analysis was conducted by RevMan 5.0 software. Results: 14 controlled studies met the inclusion criteria were included, of which 5 studies were included in mortality rate outcomes, 11 studies in clinical response outcomes, 4 studys in microbiological outcome and 4 studies in nephrotoxic outcomes. Monotherapy had a higher mortality rate than combination therapy(OR=2.30, 95%CI [1.28, 4.13], P=0.005). The overall clinical response of monotherapy was superior to combination therapy(OR=1.59, 95%CI [1.03, 2.45], P=0.04),but subgroup analysis about prospective study design showed that clinical response did not differ significantly between monotherapy and combination therapy (OR=1.02, 95%CI [0.53, 1.94], P=0.96). Microbiological eradication had not difference significantly between monotherapy and combination therapy (OR=1.25, 95%CI [0.66, 2.36], P=0.50) and nephrotoxicity had also not difference(OR=0.90,95%CI [0.31, 2.61,P=0.85). Conclusion: combination therapy in the clinical response and microbiological eradication is similar to monotherapy, but in survival rates better than monotherapy. Combination therapy does not increase the nephrotoxicity of polymyxin E.
[Keywords] colistin; monotherapy; combination therapy; Acinetobacter baumannii; Pseudomonas aeruginosa; meta-analysis
1 资料与方法
1.1 纳入与排除标准
1.11 纳入标准
①研究设计及研究对象:国外有关对多粘菌素E单药和多药的安全性和有效性相关的对照试验。②病例与对照不受年龄、种族限制,语言限定于英文。③各文献研究的问题和方法相似。④检测标准统一,对结果的判断界值一致。⑤对于重复报告、资料雷同的研究仅纳入方法学较好的研究。⑤优先纳入随机和半随机对照试验,无论是否采用盲法或分配隐藏,若未能找到相关的随机对照试验,则纳入非随机同期对照试验和回顾性病例对照。
1.12 排除标准
①没有报道结果或是药物副作用的文献。②病例诊断标准不明确。③报道重复、质量较差等无法利用的文献。
1.2 考察指标
1.2.1 各种原因引起的死亡率。
1.2.2 临床结果 定义为消除或部分改善感染的症状和体征,如体温下降、增多或减少的白细胞有所下降或上升、快速的呼吸频率在一天内递减、动脉血气值和放射结果改善等。
1.2.3 临床微生物根除结果 定义为在治疗结束后,患者致病生物体根除。
1.2.4 肾毒性结果 定义为在正常肾功能患者中,增加血清肌酐值2mg/dL,或与基线值相比肌酐清除率下降50%;在发病前有肾功能损害的患者,肌酐提高50%,或与基线值相比肌酐清除率下降50%。
1.3 资料检索
计算机检索PubMed, Embase和 Cochrane Library,检索时限截止至2013年5月,英文检索词包括Colistin、 Polymyxin E、 Colimycin、 Colisticin、 Colistin Sulfomethate、 Intravenous、Aerosolized、Nebulized、Inhaled、 Parenteral、 Intramuscular、Monotherapy、Combination。
1.4 文献筛选及资料提取
两名评价员独立地对符合纳入标准的临床试验进行资料提取,完成后进行交叉核对,如有分歧,通过双方讨论或请第三位研究者协助解决。根据提取的资料,总结每个纳入研究的特征。资料提取内容包括:作者、发表年限、国家、样本量、给药方式、年龄等。
1.5 统计分析
采用RevMan 5.0 统计软件进行Meta分析。以OR及其95%CI表示效应量。运用I²值评价异质性,若I²>50%,表明研究目标有明显的异质性,采用随机效应模型分析;若各组间无异质性,采用固定效应模型分析。若敏感性过大,则采用亚组或描述性分析。
2 结 果
2.1文献检索结果
初检出相关文献408篇,经逐层筛选后,最终纳入14[11-24]篇文献的研究。文献筛选流程及结果见图1。
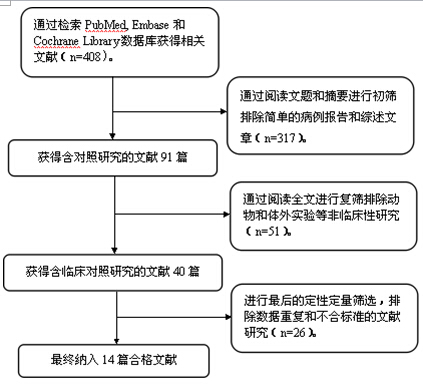
图1 文献筛选流程图
2.2 纳入研究的基本特征
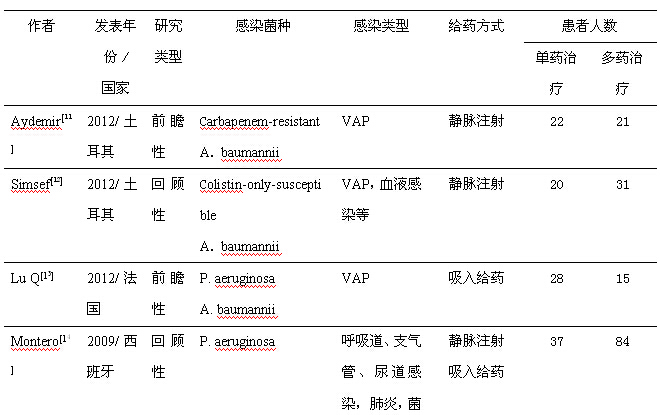
共有11[11-21]例研究纳入临床结果评价中;有4例研究[11][12][21][23]纳入微生物结果评价中;6例研究[11][12][17][19][22][23]纳入死亡率评价中,4例研究[13][17][19][21]纳入肾毒性评价中。纳入的基本信息见表1。
表1 纳入研究的基本信息



2.3 Meta分析结果
2.3.1多粘菌素E单药方案与联合方案的死亡率对比
在纳入的14篇文献中共有7篇提及了单药治疗与多药治疗的死亡率结果对比,其中包含1篇前瞻性研究[11],6篇回顾性研究[12][17][19][21][22][23]。其中Falagas等[14]提到了多粘菌素单药组与多药组在并发症、感染菌种上有显著差异,故排除此文献。最终有6篇文献报道的研究纳入分析。Meta分析结果显示,各研究间异质性不明显(P=0.77,I²=0%),故采用固定效应模型。结果显示,多粘菌素E单药方案死亡率显著大于联合方案的死亡率[OR=2.30,95%CI (1.28, 4.13),P=0.005],图2。
在纳入的6篇文献中,Aydemir 等[11]和Simsef 等[12]是针对呼吸机相关肺炎的随机对照研究,均报道了死亡率,单药方案与多药方案的死亡率结果无统计学差异[OR=1.48,95%CI (0.39, 5.59),P=0.56]。6篇文献中,有2篇研究绿脓杆菌导致的感染[11][12],2篇研究肺炎克雷伯菌导致的感染[19][20]。结果为,多粘菌素E单药方案治疗绿脓杆菌与联合方案在死亡率指标上相比,无统计学差异[OR=1.88,95%CI(0.88, 4.44),P=0.15],但治疗肺炎克雷伯菌的死亡率有显著差异[OR=3.88,95%CI (1.40, 10.73),P=0.009]。具体情况见表2。
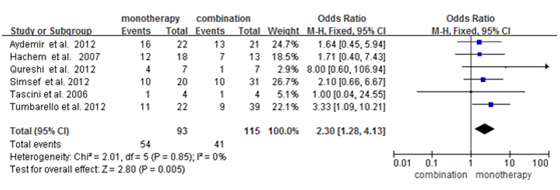
图2 多粘菌素E单药治疗与多药治疗的死亡率对比的森林图
表2 多粘菌素E单药治疗与多药治疗的死亡率对比的亚组分析

2.3.2 多粘菌素E单药方案与联合方案的临床疗效对比
11篇文献提及了单药治疗与多药治疗的临床疗效对比(n=590),5篇前瞻性研究[11][13][15][18][20]和6篇回顾性研究[12][14][16][17][19][21]。各研究结果间异质性不明显(P=0.85,I²=0%)故采用固定效应模型。结果表明,单药方案比联合方案具有更好的临床效果[OR=1.59,95%CI (1.03, 2.45),P=0.04],如图3。漏斗图分析显示结果欠对称,发表性偏倚的可能性尚不能排除,如图4。
因纳入的研究在方案设计、感染菌种和感染方式上有差异,为了更科学地描述两者临床结果,我们进行了亚组分析(表3)。结果为,当研究设计为前瞻性研究时,单药方案疗效与联合方案的相当,没有显著差异[OR=1.02,95%CI(0.53, 1.94),P=0.96];当研究设计为回顾性研究时,单药方案要显著优于联合方案[OR=2.26,95%CI (1.24, 4.15),P=0.008]。
纳入临床疗效对比的11篇文献中,有2篇文献只针对绿脓杆菌的治疗[8][9],5篇文献针对鲍曼不动杆菌的治疗[14][15][18][19][21],其余的文献包含了多种菌种的感染。针对不同菌种感染的亚组分析见表2,从表2可见,对于绿脓杆菌的治疗,单药方案与联合治疗方案无显著差异[OR=1.02,95%CI(0.45, 2.32),P=0.95];对于鲍曼不动杆菌的治疗,单药方案优于联合方案,但无统计学差异[OR=2.00,95%CI (0.93, 4.30),P=0.08]。
纳入的11篇文献中有3篇文献针对呼吸性相关肺炎引起的感染来进行研究[14-17],其它8篇文献包含了伤口感染、尿道感染、血流感染等不同部位感染的研究。对于呼吸性相关肺炎的单药与多药方案的临床疗效对比见表3,结果表明,针对呼吸性相关肺炎的治疗,多粘菌素的单药方案与多药方案在临床疗效上无显著差异[OR=0.89,95%CI (0.43, 1.88),P=0.77]。
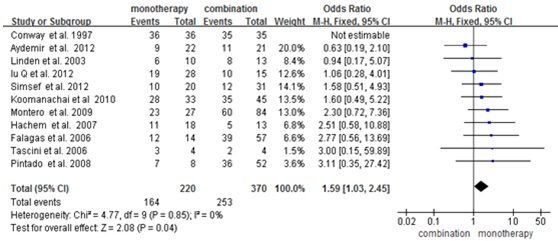
图3 多粘菌素E单药治疗与多药治疗临床疗效对比的森林图
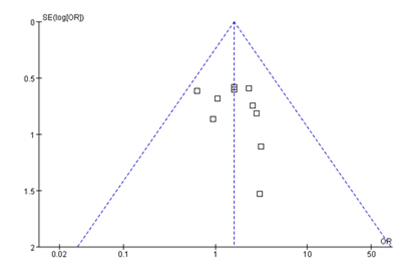
图4 多粘菌素E单药治疗与多药治疗临床对比的漏斗图
表3 多粘菌素E单药治疗与多药治疗临床疗效对比的亚组分析

2.33 多粘菌素E单药方案与多药方案的微生物根除结果对比
在纳入的13篇文献中共有4篇提及了单药方案与多药方案的微生物结果对比,2篇回顾性研究[12][21],2篇前瞻性研究[11][24]。各研究结果间异质性不明显(P=0.62,I²=0%),故采用固定效应模型。结果显示,单药方案与多药方案的微生物根除结果对比无显著差异[OR=1.25,95%CI (0.66, 2.36),P=0.50]如图5。
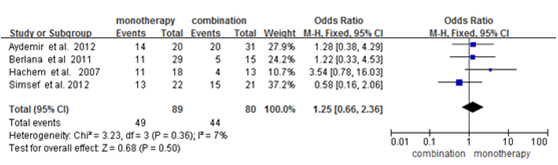
图5 多粘菌素E单药治疗与多药治疗微生物疗效对比的森林图
2.34 多粘菌素E单药方案与联合方案的肾毒性结果对比
在纳入的14篇文献中,有4篇提及了多粘菌素单药方案与联合方案的肾毒性大小的对比,且都是回顾性病例研究,各研究结果间异质性不明显(P=0.81,I²=0%),故采用固定效应模型。结果显示,联合方案的肾毒性与单药方案的相比,无显著差异[OR=0.90,95%CI (0.31, 2.61),P=0.85],见图6。
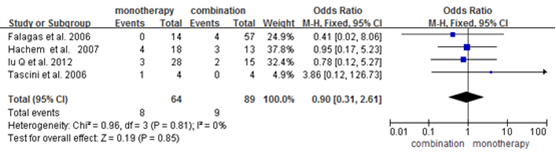
图6 多粘菌素E单药治疗与多药治疗肾毒性对比的森林图
3 讨 论
系统评价和Meta分析已被公认为客观评价某一特定问题的最佳手段,通常视为最高级别的证据。本研究采用Meta分析的方法,系统、全面的收集了截止至2013年5月期间的关于多粘菌素E单药方案与多药方案的安全性与疗效的研究,对14篇研究结果进行了合并,增加了样本量,提高了检验效能,得出的结果更可靠。
随着联合治疗方案的使用越来越广泛,医疗界对于抗生素单药和联合治疗革兰氏阴性菌和革兰氏阳性菌感染方面产生了越来越多的兴趣,但一些学者也在质疑多药治疗的临床优势性、副作用、医疗费用等一系列问题[25-27]。对于耐药菌感染的治疗,特别是多粘菌素E单药治疗方案和联合治疗方案的选择上,医药界同样产生了浓厚的兴趣。一些体外实验研究表明多粘菌素与利福平、碳氢霉烯类、氨基糖苷类等药物联用时具有协同作用[28-31],如Timurkaynak 等[31]在体外实验中利用五株鲍曼不动杆菌,证明了多粘菌素E与利福平具有协同作用;Cirioni 等[32]利用大鼠和小鼠败血症模型检查多粘菌素E结合亚胺培南或利福平对铜绿假单胞菌的作用,结果显示,与多粘菌素E单药治疗方案相比,这两个组合在72小时内有着更强的杀菌性能,其中粘菌素/亚胺培南的组合可显著降低死亡率。但是多粘菌素E单药方案与联合方案对比的相关临床研究,数量少,且质量不高,一部分文献是回顾性研究,我们在有限的条件内,整理出14篇有关于多粘菌素E单药方案与联合方案的临床对比,用Meta分析的方法,对两者疗效做出科学的系统评价。
临床结果包括临床治愈和临床改善,前者是指感染症状和特征消失,后者是指感染的症状和特征部分改善[11]。我们的研究结果表明,在临床结果上多粘菌素的单药方案优于联合方案,但因纳入文献一部分为回顾性研究,尽管研究者在两组的年龄、性别比、APACHE II 评分等指标上尽量保持一致,但仍然难做到研究背景的一致性。如Falagas 等[17]研究的两组中感染菌种的患者比例不同,单药方案组鲍曼不动杆菌感染的患者与绿脓杆菌感染的患者比例比多药组的高。据报道[21]多粘菌素E针对绿脓杆菌的最小抑菌浓度(minimum inhibitory concentration, MIC)为2ug/ml,针对鲍曼不动杆菌的MIC为0.2ug/ml,多粘菌素E又是浓度依耐性药物,这表明同一浓度下,根除绿脓杆菌更加困难一些。这也可能是导致Falagas 等[17]研究中单药方案疗效显著优于联合方案疗效[12⁄14 (85.7%) vs 39⁄57 (68.4%)]的原因。再如Pintado等[16]对一些病情较轻的感染如呼吸道感染和外伤感染等使用单药治疗,而对较重感染采用多药治疗,因此,多粘菌素E单药治疗的临床效果也就可能相应提高,从而对结果产生影响。为排除这些干扰,我们对结果进行了亚组分析,发现在前瞻性文献中由于研究的基线基本一致,多粘菌素E单药治疗组与其多药治疗组在临床结果上没有显著差异(OR=1.02,95%CI [0.53, 1.94],P=0.96),这与Petrosillo 等[33]研究的结果相似。
对于多粘菌素E单药组和多药组死亡率的分析,我们的结果显示联合方案较单药方案能更好的提高生存率[OR=2.30,95%CI (1.28, 4.13),P=0.005]。导致患者死亡有很多因素,Zarkotou O 等[34]在对克雷白杆菌引起血流感染的53名病人进行了病例对照研究,发现死亡率与多种个因素如年龄、病情严重程度、败血症的严重程度、手术成功率和抗菌药物的联合治疗等有关。 Zarkotou O 等[34]和Hirsch 等[35]认为,多粘菌素E与替加环素和碳青霉烯类药物联合,可显著提高克雷白杆菌引起血流感染病人的生存率,这与我们研究得到的结果相一致[OR=3.88,95%CI (1.40, 10.73),P=0.009]。多粘菌素E联合治疗方案可以提供更充分的抗生素初始治疗,可有效的提高患者的生存率。
多粘菌素E具有很强的肾毒性,虽然在优化用药剂量和加强对病人监护后,肾毒性出现的概率大大降低[36],但是我们仍不能忽视其肾毒性的存在。目前,多粘菌素肾毒性出现的概率大约为0%~37%[36][37]。抗生素联合治疗的目的在于提高疗效和改善药物的毒性或不增加药物的毒性,但是在我们研究纳入的4篇文献中显示,多粘菌素E联合治疗未能显著增加其肾毒性,甚至联合氨基糖苷类药物也未能使病人肾毒性显著增加[OR=0.90,95%CI (0.31, 2.61),P=0.85]。Montero 等[14]报道,121患者使用多粘菌素E后有10名患者出现了肾毒性症状,进行多变量分析发现,产生的肾毒性主要与病人之前的慢性肾功能不全、糖尿病、血管紧张素转换酶抑制剂的运用及与氨基糖苷类药物的联用有关,10名肾毒性患者有8名患者与氨基糖苷类药物进行了合用。但Lu Q 等[13]研究结果显示多粘菌素E单药治疗和多粘菌素与氨基糖苷类药物联用的肾毒性并无显著差异[3/28(10.7%) vs 2/15(13.3%)]。总之,尽管我们的研究结果显示多粘菌素E联合其它抗菌药物的多药治疗并不能显著增加多粘菌素E的肾毒性,但在联合氨基糖苷类药物后,仍应警惕患者肾脏功能的变化。
值得注意的是,本meta分析结果显示,单药方案较联合方案显著提高患者死亡率,这与临床疗效结果和微生物根除结果不一致。我们认为,首先,纳入的文献数目有限,患者群体仍较小,可能使结果产生偏倚;其次,导致患者死亡的因素有很多,很难确定是否是感染所引起的死亡,例如Hachem 等[21]在报道总体死亡率的同时也报道了感染死亡率,结果就显示多粘菌素E单药方案与联合方案在死亡率对比上没有显著差异,甚至单药治疗还具有更高的生存率[4/18(22.2%)vs 4/13(30.7%)];再者,我们纳入死亡率对比的6篇文献基本都是针对重症病人(血流感染,菌血症,休克等症状),Kumar 等[38]的meta分析认为,针对重症病人,抗生素的联合治疗方案可以提供更充分的抗生素初始治疗,从而提高患者的生存率;最后,在我们纳入的文献中,有一篇前瞻性研究[11]考察了微生物的根除速度,结果显示,联合方案根除微生物速度快,尽管其它文献未提及,但不排除这种可能性。这可能是导致治疗时间缩短,出现耐药性几率降低,从而减少患者的死亡率的主要因素之一。
虽然多粘菌素E已经成为治疗多药耐药(MDR)革兰阴性菌感染特别是鲍曼不动杆菌、铜绿假单胞菌和肺炎克雷白杆菌的重要药物,但是该药仍可出现耐药性的情况。Li等[39]在2006年报道了耐多粘菌素E的绿脓杆菌亚种群。增加药物剂量在某种程度上可以缓解感染菌对多粘菌素E的耐药,但增加剂量也面临着其肾毒性增加的问题[40]。因此,抗生素联合用药被广大医药工作者所关注。体外实验证明了联合用药可以延缓细菌耐药性的产生,但是临床数据却没有很好的证明此观点—两篇关于联合方案和单药方案的耐药性对比的meta分析证明了这一不确定性[25][41]。面对这种情况需要更多更科学的体内研究,来解决异质性耐药这一具有严重危害的潜在问题。
4 结 论
本研究纳入14篇文献,对多粘菌素E单药方案与联合方案的死亡率、临床疗效、微生物根除结果以及肾毒性方面进行了系统评价。研究受限于纳入文献的数量与质量,特别是回顾性研究占了一定比例,随机对照试验较少。但是,本Meta分析结果仍然能对临床用药起到一定的指导作用。本Meta分析结果显示,联合方案在临床疗效和微生物根除结果中并不显著优于单药方案,但在提高患者生存率上,联合方案要优于单药方案,而且多药治疗不能显著增加多粘菌素E的肾毒性,尽管如此,临床医生在进行用药时,仍要注意对病人的肾功能进行监护。在今后的研究中,亟需更多的临床对照特别是随机对照试验来从安全性、耐药性、有效性方面判断多粘菌素E单药方案与联合方案的优劣,以期对用药方案进行最优选择,对临床用药做出最科学的指导。
[参考文献]
[1] Li J, Nation RL, Turnidge JD ,et al. Colistin: the re-emerging antibiotic for multidrug-resistant gram-negative bacterial infections. [J].Lancet Infect Dis, 2006, 6(9): 589–601.
[2] Falagas ME, Kasiakou SK. Colistin: the revival of polymyxins for the management of multidrug-resistant gram-negative bacterial infections. [J].Clin Infect Dis ,2005,40(9): 1333–1341.
[3] Li J, Turnidge J, Milne R, et al. In vitro pharmacodynamic properties of colistin and colistin methanesulfonate against Pseudomonas aeruginosa isolates from patients with cystic fibrosis. [J].Antimicrob Agents Chemother ,2001, 45(3): 781–785.
[4] Nation RL, Li J. Colistin in the 21st century. [J].Curr Opin Infect Dis, 2009, 22(6): 535–543.
[5] Koch-Weser J, Sidel VW, et al.Adverse effects of sodium colistimethate. Manifestations and specific reaction rates during 317 courses of therapy. [J].Ann Intern Med ,1970, 72(6): 857–868.
[6] Payne DJ, Gwynn MN, Holmes DJ,et al. Drugs for bad bugs: confronting the challenges of antibacterial discovery. [J].Nat Rev Drug Discov, 2007,6(1):29–40.
[7] Levin AS, Barone AA, Penco J,et al. Intravenous colistin as therapy for nosocomial infections caused by multidrug-resistant Pseudomonas aeruginosa and Acinetobacter baumannii.[J].Clin Infect Dis ,1999, 28(5): 1008–1011.
[8] Durakovic N, Radojcic V, Boban A,et al. Efficacy and safety of colistin in the treatment of infections caused by multidrug-resistant Pseudomonas aeruginosa in patients with hematologic malignancy: a matched pair analysis. [J].Intern Med ,2011, 50(9): 1009–1013.
[9] Cheng CY, Sheng WH, Wang JT, et al. Safety and efficacy of intravenous colistin (colistin methanesulphonate) for severe multidrug-resistant gram-negative bacterial infections. [J].Int J Antimicrob Agents, 2010,35(3): 297–300.
[10] Apisarnthanarak A,Mundy LM. Carbapenem-resistant Pseudomonas aeruginosa pneumonia with intermediate minimum inhibitory concentrations to doripenem: combination therapy with high-dose, 4-h infusion of doripenem plus fosfomycin versus intravenous colistin plus fosfomycin.[J].Int J Antimicrob Agents,2012 ,39(3):271-272.
[11] Aydemir H, Akduman D, Piskin N et al. Colistin vs. the combination of colistin and rifampicin for the treatment of carbapenem-resistant Acinetobacter baumannii ventilator-associated pneumonia. [J].Epidemiol Infect, 2013,141(6):1214-1222.
[12] Simsek F,Gedik H,Yildirmak MT et al. Colistin against colistin-only-susceptible Acinetobacter baumannii-related infections:Monotherapy or combination therapy?[J].Indian J Med Microbiol,2012 ,30(4):448-452.
[13] Lu Q,Luo R,Bodin L,et al. Efficacy of high-dose nebulized colistin in ventilator-associated pneumonia caused by multidrug-resistant Pseudomonas aeruginosa and Acinetobacter baumannii.[J]. Anesthesiology,2012,117(6):1335-1347.
[14] Montero M,Horcajada JP,Sorlí L ,et al. Effectiveness and safety of colistin for the treatment of multidrug-resistant Pseudomonas aeruginosa infections. [J].Infection,2009,37(5):461-465.
[15] Linden PK, Kusne S, Coley K,et al. Use of parenteral colistin for the treatment of serious infection due to antimicrobial-resistant Pseudomonas aeruginosa. [J].Clin Infect Dis ,2003,37(11):154–160.
[16] Pintado V, San Miguel LG, Grill F,et al. Intravenous colistin sulphomethate sodium for therapy of infections due to multidrug-resistant Gramnegative bacteria. [J].Infect, 2008,56(2):185–190.
[17] Falagas ME, Kasiakou SK, Kofteridis DP, et al. Effectiveness and nephrotoxicity of intravenous colistin for treatment of patients with infections due to polymyxin-only-susceptible (POS) Gram-negative bacteria.[J]. Eur J Clin Microbiol Infect Dis ,2006,25(9):596–599.
[18] Conway SP, Pond MN, Watson A, et al. Intravenous colistin sulphomethate in acute respiratory exacerbations in adult patients with cystic fibrosis. [J].Thorax ,1997,52:987–993.
[19] Tascini C, Gemignani G, Palumbo F, et al. Clinical and microbiological efficacy of colistin therapy alone or in combination as treatment for multidrug resistant Pseudomonas aeruginosa diabetic foot infections with or without osteomyelitis.[J].Chemother ,2006,18(6):648–651.
[20] Koomanachai P,Tiengrim S,Kiratisin P,et al. Efficacy and safety of colistin (colistimethate sodium) for therapy of infections caused by multidrug-resistant Pseudomonas aeruginosa and Acinetobacter baumannii in Siriraj Hospital, Bangkok, Thailand.[J].Int J Infect Dis, 2007 ,11(5):402-406.
[21] Hachem RY, Chemaly RF, Ahmar CA ,et al. Colistin is effective in treatment of infections caused by multidrug-resistant Pseudomonas aeruginosa in cancer patients. [J].Antimicrob Agents Chemother, 2007, 51(6): 1905–1911.
[22] Qureshi ZA,Paterson DL,Potoski BA,et al.Treatment outcome of bacteremia due to KPC-producing Klebsiella pneumoniae: superiority of combination antimicrobial regimens. [J].Antimicrob Agents Chemother, 2012 ,56(4):2108-2113.
[23] Tumbarello M,Viale P,Viscoli C, et al. Predictors of mortality in bloodstream infections caused by Klebsiella pneumoniae carbapenemase-producing K. pneumoniae: importance of combination therapy. [J].Clin Infect Dis, 2012 ,55(7):943-950.
[24] Berlana D,Llop JM,Manresa F,et al. Outpatient treatment of Pseudomonas aeruginosa bronchial colonization with long-term inhaled colistin, tobramycin, or both in adults without cystic fibrosis. [J].Pharmacotherapy,2011 ,31(2):146-157.
[25] Bliziotis IA, Samonis G, Vardakas KZ, et al. Effect of aminoglycoside and beta-lactam combination therapy versus beta-lactam monotherapy on the emergence of antimicrobial resistance: a meta-analysis of randomized, controlled trials. [J].Clin Infect Dis,2005,41(2):149–158.
[26] Bliziotis IA, Ntziora F, Lawrence KR,et al. Rifampin as adjuvant treatment of Gram-positive bacterial infections: a systematic review of comparative clinical trials.[J].Eur J Clin Microbiol Infect Dis, 2007,26(12): 849–856.
[27] Paul M, Benuri-Silbiger I, Soares-Weiser K, et al. Beta lactam monotherapy versus beta lactam-aminoglycoside combination therapy for sepsis in immunocompetent patients: systematic review and meta-analysis of randomised trials. [J].BMJ ,2004, 328(7441): 668.
[28] Hogg GM, Barra JG, Webb CH. In-vitro activity of the combination of colistin and rifampin against multidrug-resistant strains of Acinetobacter baumannii. [J].J Antimicrob Chemother 1998,41(4): 494–495.
[29] Song JY, Kee SY, Hwang IS, et al. In vitro activities of carbapenem ⁄ sulbactam combination, colistin, colistin⁄rifampicin combination and tigecycline against carbapenem-resistant Acinetobacter baumannii. [J].J Antimicrob Chemother, 2007,60(2): 317–322.
[30] Rynn C, Wootton M, Bowker KE,et al. In vitro assessment of colistin’s antipseudomonal antimicrobial interactions with other antibiotics. [J].Clin Microbiol Infect ,1999, 5(1): 32–36.
[31] Timurkaynak F, Can F, Azap OK, et al. In vitro activities of non-traditional antimicrobials alone or in combination against multidrugresistant strains of Pseudomonas aeruginosa and Acinetobacter baumannii isolated from intensive care units. [J].Int J Antimicrob Agents ,2006, 27(3): 224–228.
[32] Cirioni O, Ghiselli R, Silvestri C,et al. Efficacy of tachyplesin III, colistin, and imipenem against a multiresistant Pseudomonas aeruginosa strain. [J].Antimicrob Agents Chemother 2007, 51(6): 2005–2010.
[33] Petrosillo N, Ioannidou E, Falagas ME. Colistin monotherapy vs. combination therapy: evidence from microbiological, animal and clinical studies.[J]. Clin Microbiol Infect, 2008,14(9): 816–827.
[34] Zarkotou O, Pournaras S, Tselioti P, et al. Predictors of mortality in patients with bloodstream infections caused by KPC-producing Klebsiella pneumoniae and impact of appropriate antimicrobial treatment. [J].Clin Microbiol Infect ,2011, 17(12):1798–803.
[35] Hirsch EB, Tam VH. Detection and treatment options for Klebsiella pneumoniae carbapenemases (KPCs): an emerging cause of multidrugresistant infection.[J].Antimicrob. Chemother,2010,65(6):1119-1125.
[36] Falagas ME, Kasiakou SK. Toxicity of polymyxins: a systematic review of the evidence from old and recent studies. [J].Crit Care, 2006,10(1): R27.
[37] Pogue JM, Lee J, Marchaim D, et al. Incidence of and risk factors for colistin-associated nephrotoxicity in a large academic health system. [J].Clin Infect Dis ,2011,53(9): 879–884.
[38] Kumar A, Safdar N, Kethireddy S, et al. A survival benefit of combination antibiotic therapy for serious infections associated with sepsis and septic shock is contingent only on the risk of death: a meta-analytic/meta-regression study. [J].Crit Care Med ,2010,38(8):1651-1664.
[39] Li J, Rayner CR, Nation RL,et al. Heteroresistance to colistin in multidrug-resistant Acinetobacter baumannii. [J].Antimicrob Agents Chemother ,2006, 50(9): 2946–2950.
[40] Falagas ME, Fragoulis KN, Kasiakou SK, et al. Nephrotoxicity of intravenous colistin: a prospective evaluation.[J]. Int J Antimicrob Agents ,2005, 26(6): 504–507.
[41] Falagas ME, Matthaiou DK, Bliziotis IA. The role of aminoglycosides in combination with a beta-lactam for the treatment of bacterial endocarditis: a meta-analysis of comparative trials. [J].J Antimicrob Chemother ,2006, 57(4):639–647.
北京药学会 地址:北京市朝阳区北三环中路2号小二楼2层
本网站浏览52291016次
Copyright 2012 北京药学会( 本网站所有内容未经许可,不得以任何形式进行转载 ) All Rights Reservered